
| A. | L层离核比M层离核近 | |
| B. | M层上电子所具有的能量高于L层上的电子 | |
| C. | 当L层上的电子数为奇数时,M层上不可能有电子 | |
| D. | M层上最多可填充8个电子 |
分析 A.原子核外电子排布按其能量的高低,能量低的轨道离核近;
B.根据构造原理判断,L层在M层里面,能量比M层低;
C.L能层上有2个能级,分别为2s、2p,每个轨道最多容纳2个电子,L层上的电子数为奇数,则L层未排满,
D.M能层上有3个能级,分别为3s、3p、3d能级,每个轨道最多容纳2个电子.
解答 解:A.原子核外电子排布按其能量的高低分成七个能层,由里向外能量由低到高依次是K、L、M、N、O、P、Q,所以L层离核比M层离核近,故A正确;
B.L层只有2s、2p能级,2s、2p能级能量比3s、3p能级低,故M层上的电子能量肯定比L层上的电子能量高,故B正确;
C.L层上的电子数为奇数,则L层未排满,元素处于第二周期,M层上不可能有电子,故C正确;
D.M能层上有3个能级,分别为3s、3p、3d能级,共有9个轨道,其中s能级最多有2个电子,p能级最多有6个电子,d能级最多有10个电子,作为内层最多可容纳18个电子,作为最外层时,最多可含有3个未成对电子,为3p3,最多可容纳8个电子,故D错误;
故选D.
点评 本题考查核外电子排布规律与运动状态,题目难度不大,注意理解核外电子的运动状态的描述.


科目:高中化学 来源: 题型:解答题
 依据“溶液中的离子平衡”相关化学知识,回答下列问题.
依据“溶液中的离子平衡”相关化学知识,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
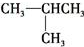 和
和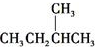
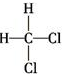 和
和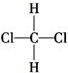
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与硝酸制TNT | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 溴乙烷水解制乙醇 | D. | 乙烯聚合为聚乙烯高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:1 | B. | 6:1 | C. | 3:1 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烯分子中所有的原子都在同一平面上 | |
| B. | 丙烯分子中三个碳原子有可能在同一条直线上 | |
| C. | 过量的丙烯通入浓溴水中,观察到溴水褪色,溶液均一稳定 | |
| D. | 丙烯既可以发生加成反应,又可以发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
 ;由①、④、⑥三种元素组成的化合物,其电子式是
;由①、④、⑥三种元素组成的化合物,其电子式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石英只能用于生产光导纤维 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 用SO2漂白纸浆和草帽辫 | |
| D. | 硅胶可作袋装食品的干燥剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com