

分析 A在标准状况下的密度为1.25g/L,则相对分子质量为1.25×22.4=28,A为乙烯,A的结构简式为CH2=CH2,A、B在常温下均为气态,X和Y互为同分异构体,D和G互为同系物,X有银镜反应,可知,B为HCHO,C为CH3CHO,D为CH3COOH,E为CH3CH2OH,甲醛氧化生成甲酸,G为HCOOH,甲醛还原生成甲醇,F为CH3OH,X与Y都是酯,X为甲酸乙酯HCOOCH2CH3,Y为乙酸甲酯CH3COOCH3,据此分析.
解答 解:A在标准状况下的密度为1.25g/L,则相对分子质量为1.25×22.4=28,A为乙烯,A的结构简式为CH2=CH2,A、B在常温下均为气态,X和Y互为同分异构体,D和G互为同系物,X有银镜反应,可知,B为HCHO,C为CH3CHO,D为CH3COOH,E为CH3CH2OH,甲醛氧化生成甲酸,G为HCOOH,甲醛还原生成甲醇,F为CH3OH,X与Y都是酯,X为甲酸乙酯HCOOCH2CH3,Y为乙酸甲酯CH3COOCH3,
(1)据分析B为甲醛,结构简式为HCHO,故答案为:HCHO;
(2)D为CH3COOH,F为CH3OH,D与F在浓硫酸作用下发生酯化反应生成乙酸甲酯,故答案为:酯化反应;
(3)C为CH3CHO,D为CH3COOH,C氧化生成乙酸,反应方程式为2CH3CHO+O2→2CH3COOH,E为CH3CH2OH,G为HCOOH,E与G在浓硫酸作用下发生酯化反应生成甲酸乙酯,化学方程式为HCOOH+CH3CH2OH$?_{△}^{浓硫酸}$HCOOCH2CH3+H2O,故答案为:2CH3CHO+O2→2CH3COOH;HCOOH+CH3CH2OH$?_{△}^{浓硫酸}$HCOOCH2CH3+H2O.
点评 本题考查有机物的推断,是高考中的常见题型,属于中等难度的试题.试题综合性强,贴近高考.在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养.旨在培养学生分析、归纳、总结问题的能力.有利于培养学生的逻辑推理能力和创新思维能力.该题的关键是根据D用正推方法解答,注意把握题给信息.


科目:高中化学 来源: 题型:填空题
 ,其化学键的类型为离子键、共价键.
,其化学键的类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
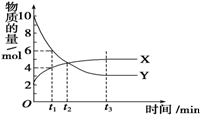 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | B. | t1时,Y的浓度是X浓度的1.5倍 | ||
| C. | t2时,正、逆反应速率相等 | D. | t3时,逆反应速率大于正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
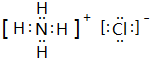 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:②>③ | B. | 电负性:③>② | ||
| C. | 晶格能:NaCl>NaF | D. | 最高正化合价:③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
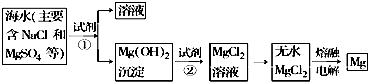
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、CO32-、Cl- | B. | Na+、H+、SO42-、SiO32- | ||
| C. | H+、NH4+、SO42-、I- | D. | H+、Fe2+、Cl-、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com