
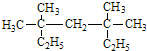 系统命名为
系统命名为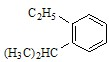 的炔烃的结构简式
的炔烃的结构简式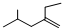 系统命名为
系统命名为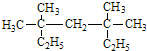 ,该有机物为烷烃,最长碳链含有7个C,主链为庚烷,编号从左下方或者右下方都可以,在3、5号C各含有2个甲基,该有机物命名为:3,3,5,5-四甲基庚烷,
,该有机物为烷烃,最长碳链含有7个C,主链为庚烷,编号从左下方或者右下方都可以,在3、5号C各含有2个甲基,该有机物命名为:3,3,5,5-四甲基庚烷,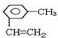 ,
, ;
; 的侧链添加碳碳三键,只有一种添加方法,得到的有机物的结构简式为:
的侧链添加碳碳三键,只有一种添加方法,得到的有机物的结构简式为: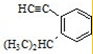 ,
, ;
;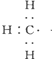 ,
,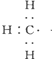 ;
; 为烯烃的键线式,含有碳碳双键的最长碳链含有5个C,主链为戊烯,编号从距离碳碳双键最近的一端开始,碳碳双键在1号C,在2号C含有1个乙基,在4号C含有1个甲基,该有机物命名为:4-甲基-2-乙基-1-戊烯,
为烯烃的键线式,含有碳碳双键的最长碳链含有5个C,主链为戊烯,编号从距离碳碳双键最近的一端开始,碳碳双键在1号C,在2号C含有1个乙基,在4号C含有1个甲基,该有机物命名为:4-甲基-2-乙基-1-戊烯,

科目:高中化学 来源: 题型:
| A、金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 |
| B、用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 |
| C、邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小 |
| D、向某溶液中加入茚三铜试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
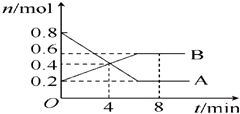
查看答案和解析>>
科目:高中化学 来源: 题型:
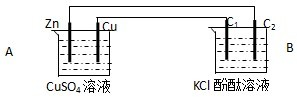
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com