
| A. | 丙烷 | B. | 丙酮 | C. | 乙醛 | D. | 甲酸乙酯 |
分析 核磁共振氢谱中有几个不同的峰,分子中就有几种H原子,峰的面积之比等于氢原子数之比,核磁共振氢谱图有3三种信号,说明分子中有3种H原子.利用等效氢原子判断:①分子中同一甲基上连接的氢原子等效;②同一碳原子所连甲基上的氢原子等效,同一同一碳原子所连氢原子等效;③处于镜面对称位置上的氢原子等效.
解答 解:A.CH3CH2CH3中有2种H原子,核磁共振氢谱有2个吸收峰,故A错误;
B.CH3COCH3中有2种H原子,核磁共振氢谱有2个吸收峰,故B错误;
C.CH3CHO中有2种H原子,核磁共振氢谱有2个吸收峰,故C错误;
D.HCOOCH2CH3中有3种H原子,核磁共振氢谱有3个吸收峰,故D正确.
故选D.
点评 本题以核磁共振氢谱为载体考查有机物的结构,难度较小,清楚核磁共振氢谱中有几个不同的峰,分子中就有几种H原子.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
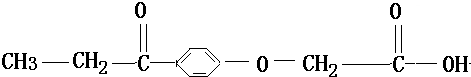
| A. | 1mol利尿酸最多可与5molH2发生加成反应 | |
| B. | 利尿酸分子中位于同一平面内的原子有10个 | |
| C. | 利尿酸分子式是C11H12O4 | |
| D. | 利尿酸与新制Cu(OH)2悬浊液反应有红色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
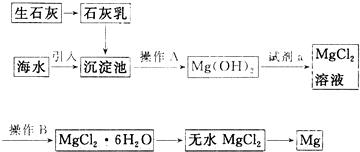
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同位素(${\;}_{1}^{1}$H20与${\;}_{1}^{2}$H2O) | B. | 同素异形体(13C与C60) | ||
| C. | 同分异构体( 与CH3COOH) 与CH3COOH) | D. | 同系物(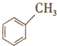 与 与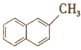 ) ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学计量数的关系:b<c | |
| B. | 容器的容积减小后,该反应的逆反应速率减小 | |
| C. | 原容器中用B浓度变化表示该反应在1 min内的速率为$\frac{cx}{b}$mol•(L•min)-1 | |
| D. | 若保持温度和容器容积不变,充入氦气(不参与反应),平衡不发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子组K+、Fe2+、NO3-、I-因发生氧化还原反应而不能大量共存 | |
| B. | 离子组K+、Na+、ClO-、Cl-中加入稀硫酸后还能够大量共存 | |
| C. | 过量SO2通入氨水的反应为SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| D. | Na2CO3溶液显碱性的原因主要是CO32-+H20?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com