
| A. | 某温度时,化学反应速率无论用哪种物质表示,其数值是相等的 | |
| B. | 其他条件不变,降低温度,反应速率减慢 | |
| C. | 其他条件不变时,增大压强,化学反应速率一定加快 | |
| D. | 若增加或减少A的物质的量,反应速率一定会发生明显的变化 |
分析 A.不同物质表示的反应速率之比等于其化学计量数之比;
B.其他条件不变,降低温度,活化分子百分数减小、活化分子数目减小,反应速率减慢;
C.增大压不影响物质的浓度,化学反应速率不变;
D.A可能为固体或纯液体.
解答 解:A.不同物质表示的反应速率之比等于其化学计量数之比,其数值可能相等,也可能不相等,但表示反应快慢相等,故A错误;
B.其他条件不变,降低温度,活化分子百分数减小、活化分子数目减小,反应速率减慢,故B正确;
C.若没有气体参与,增大压强基本不影响化学反应速率,故C错误;
D.若A为固体或纯液体,增加或减少A的物质的量,其浓度不变,不影响反应速率,故D错误,
故选B.
点评 本题考查化学反应速率及其影响因素,比较基础,注意对速率规律的理解,注意压强影响物质的浓度,进而影响反应速率.


科目:高中化学 来源: 题型:多选题
| A. | 溴苯中混有溴,加入氢氧化钠溶液后分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C-C键可以绕键轴自由旋转,结构简式为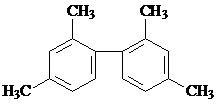 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| B. | 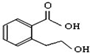 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯取代产物为5种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 3 | ① | ③ | ④ | ⑨ | ||||
| 4 | ② |
 .
.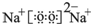 ,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA
,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | 仅②③ | C. | 仅① | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ③⑤⑦ | C. | ①②④⑤⑥ | D. | ②③④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com