
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI>Ag2CrO4 B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
选C。AgCl(s) Ag+(aq)+Cl-(aq),AgCl饱和溶液中Ag+和Cl-的浓度相等,Ksp(AgCl)=c(Ag+)×c(Cl-)=c2(Ag+),故AgCl饱和溶液中c(Ag+)=
Ag+(aq)+Cl-(aq),AgCl饱和溶液中Ag+和Cl-的浓度相等,Ksp(AgCl)=c(Ag+)×c(Cl-)=c2(Ag+),故AgCl饱和溶液中c(Ag+)=
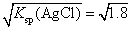 ×10-5mol·L-1;同理AgI饱和溶液中c(Ag+)=
×10-5mol·L-1;同理AgI饱和溶液中c(Ag+)=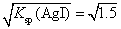 ×10-8mol·L-1;Ag2CrO4(s)
×10-8mol·L-1;Ag2CrO4(s) 2Ag+(aq)+ Cr
2Ag+(aq)+ Cr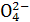 (aq),Ag2CrO4饱和溶液中2c(Cr
(aq),Ag2CrO4饱和溶液中2c(Cr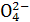 )
)
=c(Ag+),Ksp(Ag2CrO4)=c2(Ag+)×c(Cr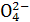 )=c3(Ag+)/2,故Ag2CrO4饱和溶液中c(Ag+)=
)=c3(Ag+)/2,故Ag2CrO4饱和溶液中c(Ag+)=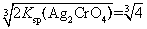 ×10-4mol·L-1;Ag+浓度大小顺序是Ag2CrO4>AgCl>AgI。
×10-4mol·L-1;Ag+浓度大小顺序是Ag2CrO4>AgCl>AgI。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
为了实现铜质奖牌镀银,下列说法正确的是( )
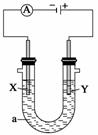
A.X为银,Y为Cu,a为AgNO3溶液
B.X的电极反应式Ag++e-—→Ag
C.电镀液的浓度减小
D.电解过程中溶液的pH值下降
查看答案和解析>>
科目:高中化学 来源: 题型:
利用生产磷铵[(NH4)3P04]排放的废渣磷灰石[(Ca3(P04)2)]制取硫酸并联产水泥的
工艺流程如下:
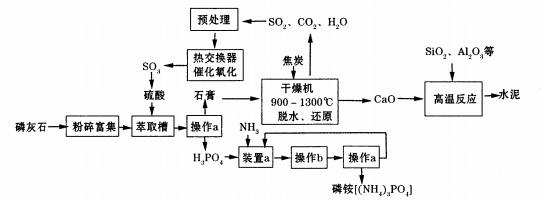
(D操作a的名称 ,实验室中进行此操作时用到的玻璃仪器有
(2)在实验室中操作b包括____、冷却结晶。
(3)干燥机中发生反应的化学方程式为 。
(4)水泥常用做建筑材料,是利用了水泥的 性质。
(5)SO2的催化氧化反应为2SO2(g)十02(g)  2S03(g)。实验测得压强及温度对
2S03(g)。实验测得压强及温度对
S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
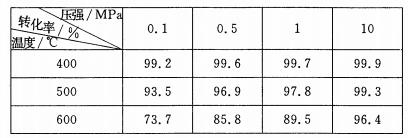
①实际生产中,S02的催化氧化反应是在常压、400℃ —500℃ 条件下进行。采用常压的
主要原因是 ;该反应化学平衡常数大小关系是:K(400℃ ) K(50o℃ )
(填“>”、“<”或“=” )。
②催化氧化时使用热交换器的原因是 。
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾。下列能
用于测定硫酸尾气中SO2含量的试剂组是 。(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2C03溶液、酚酞试液
c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
随着现代工业的发展,能源问题已经越来越引起人们的重视。科 学家们预言,未来最理想的燃料是绿色植物,即将植物的秸秆(主要成分是纤维素)用适当的催化剂作用水解成葡萄糖,再将葡萄糖转化成乙醇,用作燃料。
学家们预言,未来最理想的燃料是绿色植物,即将植物的秸秆(主要成分是纤维素)用适当的催化剂作用水解成葡萄糖,再将葡萄糖转化成乙醇,用作燃料。
(1)写出将绿色植物的秸秆转化为乙醇的化学方程式
______________________ _____________________________。
_____________________________。
(2)已知:C2H5OH(l)+3O2(g)―→2CO2(g)+3H2O(l)
ΔH=-1 367 kJ·mol-1
CH4(g)+2O2(g)―→CO2(g)+2H2O(l)
ΔH=-890 kJ·mol-1
若某种植物的秸杆含纤维素约50%,由植物秸杆经过一系列转化得到乙醇原料的总利用率为80%,则用1 000 g秸杆为原料制得的乙醇燃料燃烧所产生的热量与 L甲烷完全燃烧产生的热量相当(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅黄色沉淀。对上述过程,下列理解或解释中正确的是( )
A.Ksp(AgCl)<Ksp(AgBr)
B.若在AgCl浊液中直接加入NaBr溶液,也会产生浅黄色沉淀
C.上述实验说明AgCl没有NaBr稳定
D.因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2FeO4是一种高效多功能水处理剂, 应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
A.Na2O2只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物
D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
现有Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A.将样品配制成溶液V1L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2mL
B.向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C.将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为cg
D.将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管I、盛有碱石灰的干燥管II,测定干燥管I增重dg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com