
【题目】哈尔滨啤酒的主要成分中含有酒精(CH3CH2OH),它的官能团是( )
A.—COOHB.—OHC.—CH3D.—CH2CH3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 石油、沼气、天然气、植物油都属于可再生能源
B. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
C. 水蒸气变为液态水时放出的能量就是该变化的反应热
D. 同温同压下,H2(g)+Cl2(g) ![]() 2HCl(g)在光照和点燃条件下的ΔH不同
2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中过氧化钠(Na2O2)中氧元素化合价为______,氧化产物是________________(填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_____________________________________________。
②每生成1 mol FeO42—转移________mol电子;若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2 ,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为__________________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)可用于合成清洁剂,可由氯气与一氧化氮在常温常压下合成。熔点:-64.5℃,沸点:-5.5℃;常温下是黄色的有毒气体,遇水易水解。已知NO不与NaOH溶液反应。请按要求回答下列问题。
(1)过量铁屑和稀硝酸充分反应制备NO的离子方程式为_____________。其他条件相同,选用铁片比铜片制备NO的优点是_______________。
(2)制备NOCl的装置如下图所示,连接顺序为a→_______________(按气流自左向右方向,用小写字母表示)
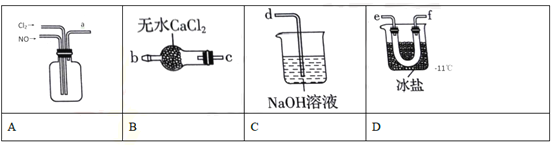
①装置A中反应的化学方程式:_______________。NOCl分子中各原子均满足8电子稳定结构,则它的电子式为_______________。
②若实验中没有安装装置B,其后果是_______________。
③实验开始应先在装置中通入Cl2,至装置A中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是_______________。
(3)工业生产过程中NO尾气处理方法有多种,其中间接电化学法,其原理如图所示:
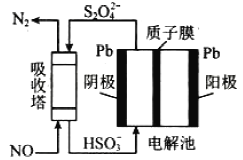
①吸收塔内发生的反应为_______________。
②阴极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)画出羟基和乙烯的电子式:羟基 __________,乙烯 __________。
(2)用系统命名法给下列有机物命名
![]() ___________________________;
___________________________;
②![]() ___________________________________;
___________________________________;
(3)相对分子质量为114,其一氯代物只有一种的链烃的结构简式 ___________该物质的名称为________________;
(4)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的键线式为 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述错误的是( )
A. 常温常压下,3.6 g H2O中所含电子数为2NA
B. 1 mol NH4HCO3晶体中,含有NH4+、NH3和NH3·H2O的总数为NA
C. 标准状况下,22.4LO2和22.4LNO混合后所得气体分子数小于1.5NA
D. 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO- 数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:將Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为___________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液 反应产生了白色沉淀 |
取______________ | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为_________________________________。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.lmol/LFeSO4溶液中加入1mL 稀硝酸 | 溶液变为棕色,放置一段时间后, 棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应I:Fe2++与HNO3反应; 反应II:Fe2+与NO反应
①依据实验现象,可推知反应I的速率比反应II_____(填“快”或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示,下列说法正确的是
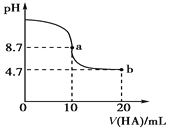
A. HA是一元强酸
B. a点所示溶液中c(Na+)>c(A-) >c(HA) >c(OH-)
C. 当pH=7时,c(Na+)=c(A-)
D. b点溶液中由水电离出的c(H+)=1.0×10-4.7 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com