

分析 G是地壳中含量最多的元素构成的单质气体,则G为O2,A、B、E、F均含钠元素,A加热分解得到B、C、D,而C、D均与E反应生成氧气,则E为Na2O2,A为NaHCO3,B为Na2CO3,C与过氧化钠反应得到碳酸钠与氧气,故C为CO2、D为H2O,则F为NaOH,据此解答.
解答 解:G是地壳中含量最多的元素构成的单质气体,则G为O2,A、B、E、F均含钠元素,A加热分解得到B、C、D,而C、D均与E反应生成氧气,则E为Na2O2,A为NaHCO3,B为Na2CO3,C与过氧化钠反应得到碳酸钠与氧气,故C为CO2、D为H2O,则F为NaOH.
(1)由上述分析可知,A为NaHCO3,B为Na2CO3,E为Na2O2,F为NaOH,
故答案为:NaHCO3;Na2CO3;Na2O2;NaOH;
(2)反应①的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
反应②的化学方程式为:NaHCO3+NaOH═Na2CO3+H2O;
反应③的化学方程式为:Na2CO3+CO2+H2O═2NaHCO3,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;NaHCO3+NaOH═Na2CO3+H2O;Na2CO3+CO2+H2O═2NaHCO3.
点评 本题考查无机物推断,涉及钠元素化合物性质语言转化,焰色反应及气体G的元素在地壳中含量为推断突破口,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )
甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 丁的氧化物可用于制造光导纤维 | |
| D. | 常温下,甲和乙的单质均能与水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
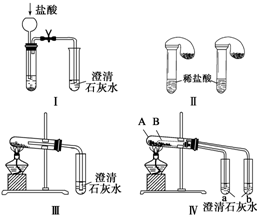
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
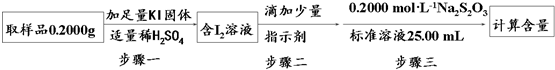
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的CH3COOH | B. | 0.1 mol•L-1的NaHSO4 | ||
| C. | 0.1 mol•L-1的NaHCO3 | D. | 0.05 mol•L-1的H2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| B. | 土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 | |
| C. | 水泥、冶金厂常用高压电除去工厂烟尘,减少对空气的污染 | |
| D. | 氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)═C(s)+$\frac{1}{2}$O2(g) | B. | 2N2O5(g)═4NO2(g)+O2(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com