
| A. | 常温常压下,23gNO2和N2O4混合气体中含O原子数为NA | |
| B. | 1mol/L Al2(SO4)3溶液中含SO42-个数为3NA,含Al3+个数小于2NA | |
| C. | 在标准状况下,将22.4L SO3溶于水配成1L溶液,所得溶液中含SO42-个数为NA | |
| D. | 将1moL 氯气通入到足量水中,则N(HClO)+N(Cl-)+N(ClO-)═2NA |
分析 A.NO2和N2O4混合气体最简式NO2,计算23gNO2中氧原子数;
B.溶液体积不知不能确定微粒数;
C.在标准状况下,SO3为固体;
D.依据氯气溶于水,少量与水反应分析判断.
解答 解:A.NO2和N2O4混合气体最简式NO2,计算23gNO2中氧原子数=$\frac{23g}{46g/mol}$×2×NA=NA,故A正确;
B.溶液体积不知不能确定1mol/L Al2(SO4)3溶液中含SO42-个数,故B错误;
C.在标准状况下,SO3为固体,不能用气体摩尔体积进行计算,故C错误;
D.将1molCl2通入到足量水中完全溶解,一部分Cl2和水反应Cl2+H2O?HCl+HClO,所以1molCl2发生氧化还原反应的量一定小于1mol,有氯气分子存在,N(HClO)+N(Cl-)+N(ClO-)+2N(Cl2)=2NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的分析,主要是气体摩尔体积计算、溶液中溶质浓度计算、元素守恒等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol羟基与1mol氢氧根离子所含有的电子数目均为9NA | |
| B. | 电解饱和食盐水,当阴极产生2.24L气体时,转移的电子数为0.2NA | |
| C. | 7.8gNa2O2和Na2S的混合物中含有的离子总数为0.7NA | |
| D. | 常温下,1L0.1mol/LNa2CO3溶液中,含有离子的总数大于0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
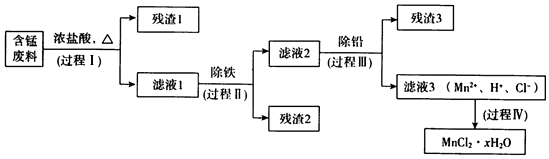
| Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.5 | 1.9 |
| 完全沉淀时 | 10.1 | 8.5 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
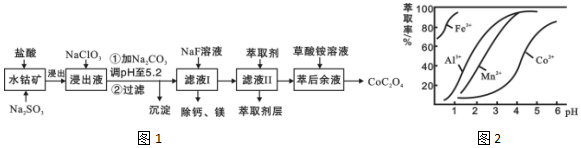
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 25℃时,KSP(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA | |
| C. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA | |
| D. | 常温下,1mol的NaHCO3固体中含HCO3-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素C、D、E的最高价氧化物对应水化物的酸性递减 | |
| B. | 元素D、E分别与元素A形成化合物的稳定性:A2D>AE | |
| C. | D、E简单离子的还原性顺序为:D>E | |
| D. | 元素B、D、E的简单离子半径大小为:B>D>E |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com