
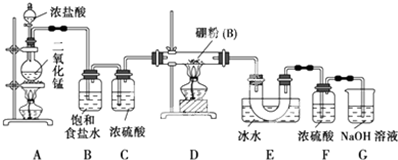
分析 在加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成Cl2,但浓盐酸具有挥发性,水被加热也能蒸发,升高温度加快浓盐酸挥发、加快水蒸发,所以生成的Cl2中含有HCl、H2O,浓硫酸具有吸水性,饱和食盐水能吸收Cl2,浓硫酸能干燥气体,从而得到较纯净的Cl2,防止生成的B和HCl、BCl3水解;D中制得BCl3,然后用E得到BCl3固体,为防止生成的BCl3水解且防止倒吸现象,所以F起到缓冲作用并干燥,G吸收未反应的Cl2,
(1)高锰酸钾与浓盐酸发生氧化还原反应生成氯化锰、氯气和水;
(2)BCl3的沸点为12.5℃,易挥发,应冷却收集;B用于除去HCl气体,可能会发生反应2B+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3↑+3H2↑,在D中加热氢气与氯气的混合气体,易发生爆炸;
(3)F装置用于吸收水蒸气,避免G装置中的水蒸气进入U形管.G装置可以盛装氢氧化钠溶液吸收尾气,以此判断;
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,在实验室保存三氯化硼的注意事项要密封保存,防止受潮水解;
(5)①先点燃A处酒精灯,待整套装置中都充满Cl2后再点燃D处酒精灯,使之发生反应;
②若先点燃D处酒精灯,这时B就与装置中的空气发生反应得到B2O3,再点燃A处酒精灯也不能产生BCl3了;
③同时点燃A、D处酒精灯也会导致产生B2O3,影响制备BCl3.
解答 解:在加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成Cl2,但浓盐酸具有挥发性,水被加热也能蒸发,升高温度加快浓盐酸挥发、加快水蒸发,所以生成的Cl2中含有HCl、H2O,浓硫酸具有吸水性,饱和食盐水能吸收Cl2,浓硫酸能干燥气体,从而得到较纯净的Cl2,防止生成的B和HCl、BCl3水解;D中制得BCl3,然后用E得到BCl3固体,为防止生成的BCl3水解且防止倒吸现象,所以F起到缓冲作用并干燥,G吸收未反应的Cl2,
(1)在A装置中用高锰酸钾固体粉末与浓盐酸发生反应可以制取氯气,反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++8H2O+5Cl2↑,
故答案为:2MnO4-+10Cl-+16H+=2Mn2++8H2O+5Cl2↑;
(2)三氯化硼的沸点低,易挥发,需要冷却产品.B装置的作用是吸收Cl2中混有的HCl,由题给资料知,硼与氯化氢反应生成的产物中有氢气,加热氢气和氯气的混合气体,易发生爆炸,
故答案为:冷却和收集三氯化硼;硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸;
(3)F装置用于吸收水蒸气,避免G装置中的水蒸气进入U形管.G装置可以盛装氢氧化钠溶液吸收尾气,故实验中可以用一个盛装碱石灰的干燥管来代替F+G装置,
故答案为:碱石灰;
(4)因硼与铝的性质相似,硼酸的化学式为H3BO3,类似铝酸(H3AlO3).因三氯化硼遇水能反应,反应的化学方程式为:BCl3+3H2O=H3BO3+3HCl↑,故实验室应密封冷暗处保存三氯化硼,
故答案为:BCl3+3H2O═H3BO3+3HCl↑;
(5)①先点燃A处酒精灯,待整套装置中都充满Cl2后再点燃D处酒精灯,使之发生反应,故正确;
②若先点燃D处酒精灯,这时B就与装置中的空气发生反应得到B2O3,再点燃A处酒精灯也不能产生BCl3了,故错误;
③同时点燃A、D处酒精灯也会导致产生B2O3,影响制备BCl3,错误;
故答案为:①.
点评 本实验属于物质制备与检验综合设计实验,为高频考点,侧重于学生的分析能力和实验能力的考查,题目涉及制备气体、净化气体、干燥气体和尾气处理,明确流程图中各个装置作用及其实验原理,题目难度中等.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
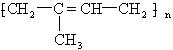 某有机化合物能在一定条件下发生加聚反应,生成高分子有机物,其结构简式如图,则合成该高聚物的单体是( )
某有机化合物能在一定条件下发生加聚反应,生成高分子有机物,其结构简式如图,则合成该高聚物的单体是( )| A. | 2-甲基-2-丁烯 | B. | 乙烯和丙烯 | ||
| C. | 1,3-T二烯 | D. | 2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
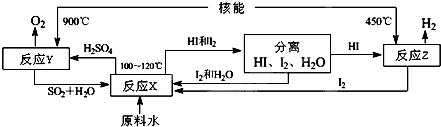
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
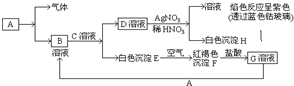 已知有以下物质相互转化,已知,A是世界上用量最大的金属单质,试回答:(1)写出E的化学式Fe(OH)2F的化学式Fe(OH)3;
已知有以下物质相互转化,已知,A是世界上用量最大的金属单质,试回答:(1)写出E的化学式Fe(OH)2F的化学式Fe(OH)3;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
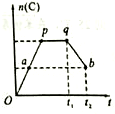 在一定条件,可逆反应:mA+nB?pC达到平衡状态.
在一定条件,可逆反应:mA+nB?pC达到平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放 | |
| B. | 新能源的优点主要是资源丰富、可再生、没有或很少有污染 | |
| C. | 氢能的优点热值高、资源丰富、燃烧产物无污染;缺点是储存和运输困难 | |
| D. | 高纯度的硅单质广泛用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
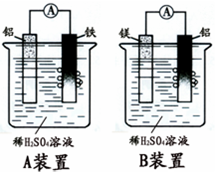 有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,
有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
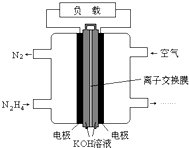 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )| A. | 电流从右侧电极经过负载后流向左侧电极 | |
| B. | 负极发生的电极反应式为N2H4+4OH--4e-=N2+4H2O | |
| C. | 该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com