
����Ŀ��ij������Ʒ���Ѿ����������ʣ������������Al2O3��Fe2O3��CuO����ѧ��ȤС���������ֽ�����������Է��룬�����Ƶ���Ӧ�Ĵ������������Һ��ʵ�鷽���������£�
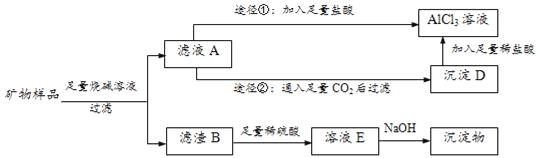
��1����Fe2O3��CuO����ɫ������___ɫ��___ɫ��
��2��д����ҺA����Ҫ���ʳɷ֣�___��
��3������ҺA��AlCl3��Һ�Тٺ͢�����;���������������������֮���������ǣ�___��
��4����ҺE�к������������ӣ���E�зֲ��μ�NaOH��Һ�������������Ⱥ���OH����ϣ������еڶ�λ����������ʹij���Լ���ΪѪ��ɫ�������Լ���___����������Ʒ������Ϊm1������Fe(OH)3������Ϊm2������Ʒ��Fe2O3����������Ϊ___����ʹFe3+������һ�������NaOH�������òⶨֵ��___������ƫ��������ƫ������������������
��5����Cu(OH)2����ϡ���ᣬȻ���Ƴɵ������壬��Ҫ�IJ����������ΰ�������Ũ����___��___��ϴ�ӡ���Ȼ����ȡ�
���𰸡����� �� NaOH��NaAlO2 ;�����Ƶõ��Ȼ�����Һ���ȸ�,;������ȡ��AlCl3��Һ�л���NaCl���� KSCN��Һ ![]() ��100% ƫ�� ��ȴ�ᾧ ����
��100% ƫ�� ��ȴ�ᾧ ����
��������
������Ʒ���Ѿ����������ʣ������������Al2O3��Fe2O3��CuO�����������ռ���Һ���ˣ��������ܽ�����ƫ�����ƣ�������������ͭ���ܽ⣬��ҺAΪNaAlO2������NaOH������BΪFe2O3��CuO����������ϡ�����ܽ�õ�������������ͭ��ҺE����������������Һ���ɳ�������������������ͭ����ҺA�����������������Ȼ������Ȼ�����Һ����ҺAͨ������������̼���˵õ�������������D�������м�������ϡ����õ��Ȼ�����Һ��
��1��������Ϊ����ɫ������ͭΪ��ɫ��
��2��������֪��ҺAΪƫ��������Һ������������Һ��
��3���������ʵ����ʽ�Ͽ�ͼת����ϵ�����ò�Ʒ���н��
��4����ҺE�к������������ӣ�ΪH+��Fe3+��Cu2+����E�зֲ��μ�NaOH��Һ�������������Ⱥ���OH-��ϣ������еڶ�λ����������ʹij���Լ���ΪѪ��ɫΪ�����ӽ���������������Ѫ��ɫ��Һ��Ԫ���غ����������������������ʹFe3+������һ�������NaOH����������������ͭ������������������
��5������Һ��Ҫ�������壬������ȴ�ᾧ����Ȼ�����ϴ�ӡ����
������Ʒ���Ѿ����������ʣ������������Al2O3��Fe2O3��CuO�����������ռ���Һ���ˣ��������ܽ�����ƫ�����ƣ�������������ͭ���ܽ⣬��ҺAΪNaAlO2������NaOH������BΪFe2O3��CuO����������ϡ�����ܽ�õ�������������ͭ��ҺE����������������Һ���ɳ�������������������ͭ����ҺA�����������������Ȼ������Ȼ�����Һ����ҺAͨ������������̼���˵õ�������������D�������м�������ϡ����õ��Ȼ�����Һ��
��1����Fe2O3��CuO����ɫ�����Ǻ���ɫ����ɫ��
�ʴ�Ϊ�����أ��ڣ�
��2����ҺA����Ҫ���ʳɷ�Ϊ�������������ƺ����ɵ�ƫ�����ƣ���ѧʽΪ��NaOH��NaAlO2��
�ʴ�Ϊ��NaOH��NaAlO2��
��3��;���ٷ�����Ӧ��NaAlO2+4HCl=AlCl3+NaCl+2H2O��NaOH+HCl=NaCl+H2O���������ᣬ�Ȼ������ʣ�
�ʴ�Ϊ��;�����Ƶõ��Ȼ�����Һ���ȸߣ�;������ȡ��AlCl3��Һ�л���NaCl���ʣ�
��4����ҺE�к������������ӣ�ΪH+��Fe3+��Cu2+����E�зֲ��μ�NaOH��Һ�������������Ⱥ���OH����ϣ������еڶ�λ����������ʹij���Լ���ΪѪ��ɫΪ�����ӽ���������������Ѫ��ɫ��Һ���Լ�ΪKSCN��Һ��Ԫ���غ������������������=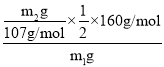 ��100%=
��100%=![]() ��100%����ʹFe3+������һ�������NaOH����������������ͭ��������������������õ�����������������ƫ�ߣ�
��100%����ʹFe3+������һ�������NaOH����������������ͭ��������������������õ�����������������ƫ�ߣ�
�ʴ�Ϊ��KSCN��Һ��![]() ��100%��ƫ�ߣ�
��100%��ƫ�ߣ�
��5������Һ��ȡ���壬�辭������Ũ������ȴ�ᾧ������ϴ�ӡ�����ſɵõ�����Cu(OH)2����ϡ���ᣬȻ���Ƴɵ������壬��Ҫ�IJ����������ΰ�������Ũ������ȴ�ᾧ������ϴ�ӡ����
�ʴ�Ϊ����ȴ�ᾧ�����ˡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ʊ��������Ҫ��Ӧ֮һΪSO2��O2��Ӧ����SO3����ش��������⣺

��1��SO2��O2��Ӧ����SO3�ķ�Ӧ���̵������仯��ͼ1��ʾ����ͼ�����߱仯��֪���÷�ӦΪ___(������������������������Ӧ��
��2��������������ʱ����ͬ�¶���SO2��ת������ʱ��ı仯�����ͼ2��ʾT1___(����>������<����T2��
��3��ij��ʵ���У����ݻ�Ϊ2L�ĺ��º����ܱ�������ͨ��2molSO2��bmolO2����Ӧ�����в������ʵ����ʵ����淴Ӧʱ��ı仯��ͼ3��ʾ��
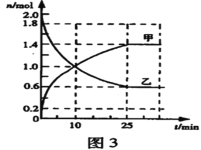
�ټ�Ϊ___(�ѧʽ����ͬ������Ϊ___��
��SO2��O2����SO3�ķ�Ӧ��___��Ӧ��(������������������������
��10minʱ��v��(SO2) _______ v��(SO2)��(����>������<������=����
�ܴӷ�Ӧ��ʼ��ƽ�⣬��Ӧ����v(SO3)=___��
�ݵ�b=___ʱ��O2��SO2��ת������ȡ�
��Ӧ�ﵽƽ��ʱ��SO2��ת����Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L���ܱ������з�����Ӧ��4A��s��+3B��g��2C��g��+D��g����2min��B��С��1.2mol���йش˷�Ӧ��˵����ȷ���ǣ�������
A. �� 2min �ڵķ�Ӧ���ʣ��� C ��ʾ�� 0.4mol/��Lmin��
B. �ֱ��� B��C��D ��ʾ��ѧ��Ӧ�������ֵ�� 3��2��1
C. �ﵽ��ѧ��Ӧ��ʱ��B ����ת����Ϊ 100%
D. ������������ A ��Ͷ�������Լӿ�÷�Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£������Ϊ2L�ĺ����ܱ������У�ijһ��Ӧ��X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ�����б�������ȷ����
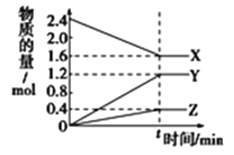
A.��Ӧ�Ļ�ѧ����ʽΪ![]()
B.tʱ�������淴Ӧ�����ټ������У���Ӧ�ﵽ��ѧƽ��
C.��![]() ����
����![]() X�Ļ�ѧ��Ӧ����Ϊ0.1molL-1min-1
X�Ļ�ѧ��Ӧ����Ϊ0.1molL-1min-1
D.�¶ȡ�������䣬tʱ�̳���1molHeʹѹǿ���������淴Ӧ���ʶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش����⣺
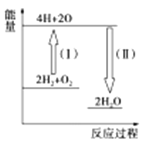
(1)����ȼ������Һ̬ˮ���Ȼ�ѧ����ʽ��2H2(g)+O2(g)=2H2O(1)������2molҺ̬ˮ�ų�572kJ����������ش��������⣺
�������������ܺ�___(������������С��������������)��Ӧ�������ܺ͡�
�ڷ�Ӧ2H2+O2![]() 2H2O�������仯��ͼ��ʾ����֪��1mol H2��1mol O2��1mol H��O�еĻ�ѧ���ֱ���Ҫ����436kJ��496kJ��463kJ����������Ӧ����(��)____(���������������ų���)___kJ��
2H2O�������仯��ͼ��ʾ����֪��1mol H2��1mol O2��1mol H��O�еĻ�ѧ���ֱ���Ҫ����436kJ��496kJ��463kJ����������Ӧ����(��)____(���������������ų���)___kJ��
(2)һ���¶��£����ݻ�Ϊ2L���ܱ������н��з�Ӧ��aN(g)![]() bM(g)+cP(g)��M��N��P�����ʵ�����ʱ��仯��������ͼ��ʾ��
bM(g)+cP(g)��M��N��P�����ʵ�����ʱ��仯��������ͼ��ʾ��
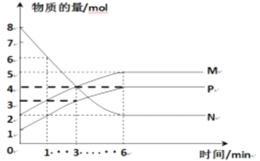
�ٷ�Ӧ��ѧ����ʽ�и����ʵ�ϵ����Ϊa��b��c��____��
��1min��3min���ʱ�̣���M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ��_______��
��������������˵��������Ӧ�ﵽƽ��״̬����_________��
A ��Ӧ�е�M��N�����ʵ������ʱ
B P����������ʱ��仯���仯
C �������������ʵ�������ʱ��仯���仯
D ��λʱ����ÿ����a mol N��ͬʱ����b mol M
E ��������ѹǿ����ʱ��ı仯���仯
M �����ʵ���Ũ�ȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵĹ�ҵ���������У�����Ҫ��Ӧ���漰������ԭ��Ӧ���ǣ� ��
A.����B.����C.�ռ�D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
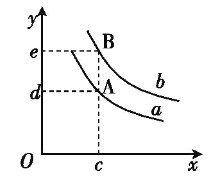
����Ŀ��SiCl4��������Ϊ��ɫҺ�壬�ӷ�����ǿ�ҵĴ̼��ԡ���SiCl4��ת��ΪSiHCl3���پ�������ԭ���ɸߴ��衣һ�������£���20L�����ܱ������з���SiCl4ת��ΪSiHCl3�ķ�Ӧ��3SiCl4(g)+2H2(g)+Si(s)SiHCl3(g)����H=QkJmol-1��2min��ﵽƽ�⣬H2��SiHCl3�����ʵ���Ũ�ȷֱ�Ϊ0.1mol/L��0.2mol/L��
��1���ӷ�Ӧ��ʼ��ƽ�⣬v(SiCl4)=_______
��2���÷�Ӧ��ƽ�ⳣ������ʽΪK=_______���¶�����,Kֵ������Q__0(����>������<������=��)��
��3����ƽ������������г�������ʼʱ������SiCl4��H2(����Si����)������Ӧ�ٴδﵽƽ��ʱ����ԭƽ����Ƚϣ�H2�����������____(����������������С������������)��
��4��ԭ�����У�ͨ��H2�����(��״����)Ϊ_________
��5��ƽ��������������Ϊ10L���ٴδﵽƽ��ʱ,H2�����ʵ���Ũ�ȷ�ΧΪ__________
��6��ͼ��x���ʾ�¶ȣ�y���ʾƽ��������H2�����������a��b��ʾ��ͬ��ѹǿ����ѹǿa____b(����>������<������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���![]() (I)��
(I)��![]() (II)��
(II)��![]() (III)��
(III)��![]() (IV)�������˵����ȷ����
(IV)�������˵����ȷ����
A. ���������������ķе��������� B. �������һ�ȴ����ֻ������
C. ��������̼ԭ�ӿ��ܶ�����ͬһƽ�� D. �����������ڷ����廯�����Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A����ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D�������ʣ��ṹ��ʽ��ͼ��ʾ��
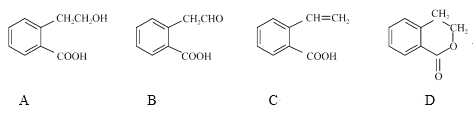
��1��A�ķ���ʽ��____��B�еĺ���������������____��
��2��A��B�ķ�Ӧ������___��A��D�л�Ϊͬ���칹�����___������ţ���
��3��D������������ˮ��Ļ�ѧ����ʽ��____��
��4��B����������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽ��___________��
��5����������������A��ͬ���칹����____�֡�
�ٹ�������A��ȫ��ͬ���뱽��ֱ���������ڱ�����������ȡ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com