
| A. | Al2O3$\stackrel{盐酸}{→}$AlCl3溶液$\stackrel{蒸发}{→}$AlCl3 | |
| B. | Cu$\stackrel{稀硫酸}{→}$CuSO4溶液$\stackrel{冷却结晶}{→}$CuSO4•5H2O | |
| C. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{NaOH}{→}$Fe(OH)3$\stackrel{△}{→}$Fe2O3 | |
| D. | Mg$\stackrel{空气中燃烧}{→}$MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{蒸发}{→}$MgCl2 |
分析 A.氧化铝是两性氧化物和盐酸反应生成氯化铝溶液,氯化铝溶液中铝离子水解生成氢氧化铝和盐酸,蒸发溶液氯化氢挥发促进水解得到水解产物氢氧化铝;
B.铜和稀硫酸不发生反应;
C.铁和氯气反应生成氯化铁,氯化铁和氢氧化钠溶液反应生成氢氧化铁沉淀,氢氧化铁受热分解生成氧化铁;
D.镁在空气中燃烧生成氧化镁,氧化镁和盐酸反应生成氯化镁溶液,氯化镁水解生成氢氧化镁和氯化氢,蒸发溶液氯化氢挥发,促进水解,生成水解产物氢氧化镁;
解答 解:A.氧化铝是两性氧化物和盐酸反应生成氯化铝溶液,Al2O3+6HCl=2AlCl3+3H2O,氯化铝溶液中铝离子水解生成氢氧化铝和盐酸,AlCl3+3H2O?Al(OH)3+3HCl,蒸发溶液氯化氢挥发促进水解得到水解产物氢氧化铝,最后一步不能得到氯化铝,故A错误;
B.铜和稀硫酸不发生反应,第一步不能完成,故B错误;
C.铁和氯气反应生成氯化铁,2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,氯化铁和氢氧化钠溶液反应生成氢氧化铁沉淀,FeCl3+3NaOH=Fe(OH)3+3NaCl,氢氧化铁受热分解生成氧化铁,2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,能实现各步反应,故C正确;
D.镁在空气中燃烧生成氧化镁,2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,氧化镁和盐酸反应生成氯化镁溶液,MgO+2HCl=MgCl2+H2O,氯化镁水解生成氢氧化镁和氯化氢,MgCl2+2H2O?Mg(OH)2+2HCl,蒸发溶液氯化氢挥发,促进水解,生成水解产物氢氧化镁,最后一步不能得到,故D错误;
故选C.
点评 本题考查了物质性质、物质反应产物判断、盐类水解的原理分析应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 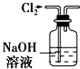 用如图所示装置除去Cl2中含有的少量HCl | |
| B. | 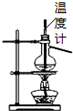 如图所示为石油分馏 | |
| C. | 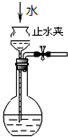 如图所示为检查装置气密性 | |
| D. | 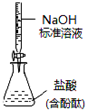 如图所示为测定未知盐酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟离子的结构示意图: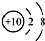 | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | 溴化铵的电子式: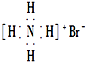 | |
| D. | 质子数为53,中子数为78的碘原子:53131 I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
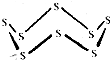 黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂只有KNO3 | |
| C. | 32g S8含有S-S的数目约为6.02×1023 | |
| D. | 1mol KNO3参与该反应,转移电子总数目约为5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
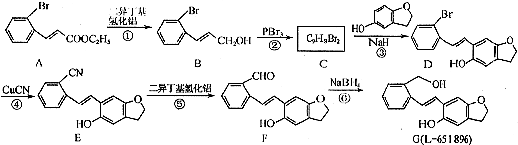
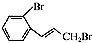 .
.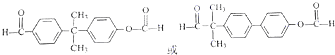 (只写一种).
(只写一种).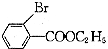 为原料制备二氢异苯并呋喃(结构简式如图
为原料制备二氢异苯并呋喃(结构简式如图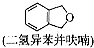 )的合成路线流程图(无机试剂可任选).
)的合成路线流程图(无机试剂可任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
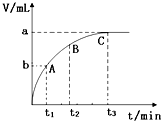 某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:
某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:| 实验序号 | 5%H2O2溶液 | 水 | 溶液温度 | 1mol/L FeCl3溶液 | 所用时间 |
| ① | 10.0ml | 0.0ml | 20℃ | 2滴 | t1 |
| ② | 9.0ml | 1.0ml | 40℃ | 2滴 | t2 |
| ③ | 5.0ml | Vx ml | 20℃ | 2滴 | t3 |
| ④ | 9.0ml | 1.0ml | 40℃ | 0 | t4 |
| ⑤ | 9.0ml | 1.0ml | 20℃ | 2滴 | t5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
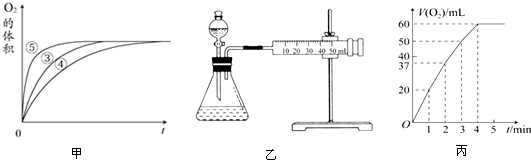
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
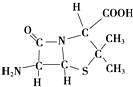 人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某种核素的相对原子质量 | |
| B. | 某种核素的原子质量 | |
| C. | 某种元素的平均相对原子质量 | |
| D. | 某种元素的平均相对原子质量的近似值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com