

| ||
| ||
 ,故答案为:
,故答案为: ;
;
| ||
| ||


科目:高中化学 来源: 题型:

| CH3C=CNa |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、重金属盐能使蛋白质变性,所以误食重金属盐时,可以喝牛奶解毒 |
| B、阿胶的主要成分是蛋白质,蚕丝的主要成份是纤维素 |
| C、蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,再加水,重新溶解 |
| D、浓硝酸溅到皮肤上,会使皮肤呈现黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
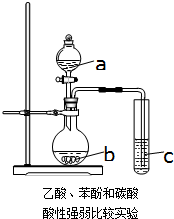 化学研究性学习小组进行验证乙酸、碳酸和苯酚溶液的酸性强弱的探究实验.设计如图一次性完成乙酸、碳酸和苯酚溶液酸性强弱验证的实验装置.
化学研究性学习小组进行验证乙酸、碳酸和苯酚溶液的酸性强弱的探究实验.设计如图一次性完成乙酸、碳酸和苯酚溶液酸性强弱验证的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
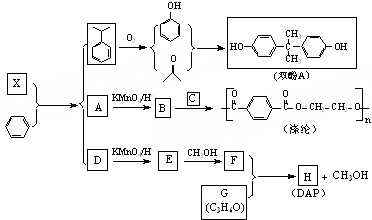
查看答案和解析>>
科目:高中化学 来源: 题型:
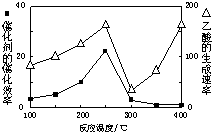 Na、Cu、Al、O、C、H是常见的六种元素.
Na、Cu、Al、O、C、H是常见的六种元素.| 第一电离能 | 离子半径 | 沸点 |
| Na | O2- | CH4 |
| 物 质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(l0b-5a))mol/L | ||||
| B、(2b-a)mol/L | ||||
C、(
| ||||
D、(5b-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A、R的氧化物对应的水化物可能具有两性 |
| B、X单质在氧气中燃烧不可能生成XO3 |
| C、离子半径大小:r(M3+)>r(T2-) |
| D、L2+和X2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
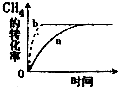 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com