
| A. | 阳极反应式相同 | |
| B. | 电解结束后所得液体的pH相同 | |
| C. | 阴极反应式相同 | |
| D. | 通过相同电量时生成的气体总体积相等(同温同压) |
分析 A.以石墨为电极分别电解水阳极上氢氧根离子放电生成氧气和水,以石墨为电极分别电解饱和食盐水阳极氯离子放电生成氯气;
B.电解水溶液pH不变,电极饱和氯化钠溶液生成氢氧化钠和氯气和氢气,pH变大;
C.以石墨为电极分别电解水和饱和食盐水都是氢离子得到电子生成氢气;
D.依据电解方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑~4e-;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑~2e-,结合转移电子数相等解答.
解答 解:A.以石墨为电极分别电解水阳极上4OH--4e-=2H2O+O2↑,以石墨为电极分别电解饱和食盐水阳极2Cl--2e-=Cl2↑,二者电极反应式不同,故A错误;
B.电解水溶液pH不变,电极饱和氯化钠溶液生成氢氧化钠和氯气和氢气,pH变大,所以电解结束后所得液体的pH不相同,故B错误;
C.以石墨为电极分别电解水和饱和食盐水都是:2H++2e-=H2↑,所以电极反应式相同,故C正确;
D.生转移电子数为4mol,则依据电解方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑~4e-,电解水生成3mol气体;
依据电解方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑~2e-,电解食盐水生成4mol气体,故D错误;
故选:C.
点评 本题考查了电解饱和食盐水和电解水,明确电解池工作原理、准确判断电极及发生反应是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的对应水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的强 | |
| D. | 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
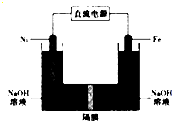 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )| A. | 电子的流动方向是从铁电极流出通过溶液到镍电极 | |
| B. | 铁作阳极,电极反应式为Fe+80H--6e-═FeO42-+4H20 | |
| C. | 镍作阳极,电极反应式为40H--4e-═O2+2H20 | |
| D. | 镍作阴极发生氧化反应在镍电极附近有H2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C,D的最高氧化物对应的水化物之问能发生反应 | |
| C. | 工业上常用电解法制备元素A、C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
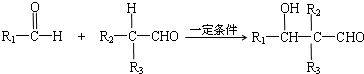
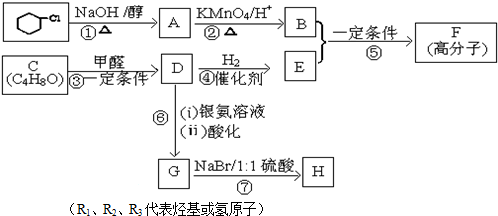
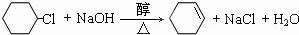 .
.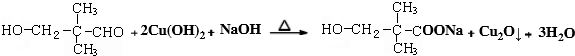
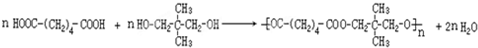 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入铁粉,铁粉不溶解 | B. | 滴入NaNO3溶液,铜片不溶解 | ||
| C. | 加入银粉,银粉不溶解 | D. | 滴入NaHCO3溶液,有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳分子的比例模型 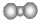 | |
| B. | 芳香烃的组成通式 CnH2n-6(n≥6) | |
| C. | 12C、14C原子结构示意图均可表示为 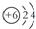 | |
| D. | 羟基的电子式 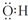 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol/L的蔗糖溶液 | B. | 0.02 mol/L的CH3COOH溶液 | ||
| C. | 0.02 mol/L的NaCl溶液 | D. | 0.01 mol/L的K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
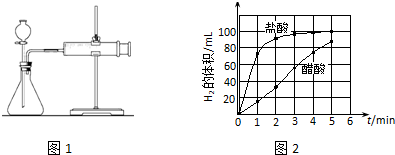
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
| 待测物理量 | 测定方法 |
| ①醋酸溶液的物质的量浓度 | 量取25.00ml醋酸溶液于锥形瓶中,滴加指示剂,将0.1000 mol•L-1 NaOH标准溶液装入 碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适量醋酸溶液于烧杯中,用pH计测定溶液pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com