
 纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )
纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )| A. | 作用时电子由Zn极经外电路流向Ag2O极,Zn是负极 | |
| B. | 使用时电子由Ag2O极经外电路流向Zn极,Ag2O是负极 | |
| C. | 正极的电极反应为Ag2O+2e-+H2O═2Ag+2OH- | |
| D. | Zn极发生氧化反应,Ag2O极发生还原反应 |
分析 根据电池反应式知,Zn失电子作负极,Ag2O作正极,负极反应式为Zn+2OH--2e-═ZnO+H2O、正极反应式为Ag2O+H2O+2e-═2Ag+2OH-,放电时,电子从负极流向正极,以此解答该题.
解答 解:A.Zn失电子作负极,Ag2O作正极,电子从负极流向正极,即电子由Zn极经外电路流向Ag2O极,故A正确;
B.电子由Zn极经外电路流向Ag2O极,故B错误;
C.Ag被还原,Ag2O极为正极,正极反应式为Ag2O+H2O+2e-═2Ag+2OH-,故C正确;
D.Zn作负极失电子发生氧化反应,Ag2O作正极得电子发生还原反应,故D正确.
故选B.
点评 本题考查化学电源新型电池,正确判断正负极是解本题关键,难点是电极反应式的书写,易错选项是C,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )
A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )| A. | 4.32 g | B. | 2.16 g | C. | 1.08 g | D. | 0.54 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:
神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
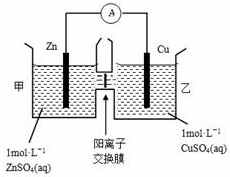
| A. | 铜电极上发生氧化反应 | |
| B. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| C. | 电池工作一段时间后,乙池的c(Zn2+)>c(SO42-) | |
| D. | 阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g 5.00% 的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.99%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g 5.00% 的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.99%,乙中c电极质量增加,据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
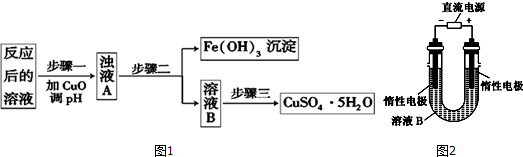
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题:
A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| C. | CO2的水溶液:c(HCO3-)>c(H+)>c(CO32-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com