
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、K+、NO3-、OH- | B. | Na+、Ba2+、Cl-、CO32- | ||
| C. | H+、Zn2+、Cl-、SO42- | D. | K+、Mg2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纤维素可在人体内水解成葡萄糖 | |
| B. | 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 | |
| C. | 用灼烧的方法可以鉴别毛织物和棉织物 | |
| D. | 油脂是产生能量最高的营养物质,在饮食中不必控制油脂的摄入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟 磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5 (P04)3F+21Si02+30C═3P4+20CaSi03+30CO+SiF4,结合上述反应中涉及到的物质或元素回答相关问题:
磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟 磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5 (P04)3F+21Si02+30C═3P4+20CaSi03+30CO+SiF4,结合上述反应中涉及到的物质或元素回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
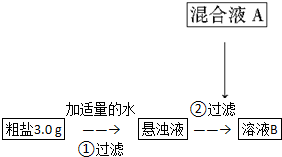
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子不存在非极性键 | |
| D. | 丙烯分子中3个碳原子不在同一直线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.4mol/L | D. | 0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只需加热 | B. | 水、氢氧化钠溶液、加热蒸发 | ||
| C. | 水、盐酸、加热蒸发 | D. | 水、氢氧化钙、过滤、蒸发 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com