

 ,G的结构简式是
,G的结构简式是 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.分析 根据信息可知, 被碱性KMnO4溶液氧化生成A,则A为
被碱性KMnO4溶液氧化生成A,则A为 ;
; 被催化氧化生成B,则B为
被催化氧化生成B,则B为 ;
; 被催化氧化生成C,则C为
被催化氧化生成C,则C为 ;
; 发生消去反应生成E,则E为
发生消去反应生成E,则E为 ;
; 与CH3OH发生酯化反应生成F,则F为
与CH3OH发生酯化反应生成F,则F为 ;
; 发生加聚反应生成G,则G为
发生加聚反应生成G,则G为 ;比较C与D的分子式可知,两分子
;比较C与D的分子式可知,两分子 发生酯化反应生成环酯D,则D为
发生酯化反应生成环酯D,则D为 ,以此解答该题.
,以此解答该题.
解答 解:根据信息可知, 被碱性KMnO4溶液氧化生成A,则A为
被碱性KMnO4溶液氧化生成A,则A为 ;
; 被催化氧化生成B,则B为
被催化氧化生成B,则B为 ;
; 被催化氧化生成C,则C为
被催化氧化生成C,则C为 ;
; 发生消去反应生成E,则E为
发生消去反应生成E,则E为 ;
; 与CH3OH发生酯化反应生成F,则F为
与CH3OH发生酯化反应生成F,则F为 ;
; 发生加聚反应生成G,则G为
发生加聚反应生成G,则G为 ;比较C与D的分子式可知,两分子
;比较C与D的分子式可知,两分子 发生酯化反应生成环酯D,则D为
发生酯化反应生成环酯D,则D为 ,
,
(1)F的结构简式为 ,则F中官能团名称为:碳碳双键、酯基;
,则F中官能团名称为:碳碳双键、酯基;
A→B的反应为 被催化氧化生成
被催化氧化生成 ,该反应为氧化反应;
,该反应为氧化反应;
C→E的反应为 发生消去反应生成
发生消去反应生成 ;
;
E→F为 与CH3OH反应生成
与CH3OH反应生成 ,该反应为酯化反应,也属于取代反应,
,该反应为酯化反应,也属于取代反应,
故答案为:碳碳双键、酯基;氧化反应;消去反应;酯化反应(或取代反应);
(2)根据上面的分析可知,D的结构简式是 ,G的结构简式是
,G的结构简式是 ,
,
故答案为: ;
; ;
;
(3)B-→C的化学方程式是: +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O,
+Cu2O↓+2H2O,
故答案为: +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O;
+Cu2O↓+2H2O;
(4)E→F的化学方程式为: +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$ +H2O;
+H2O;
(5)C为 ,与C所含官能团种类和数目都相同的同分异构体为:HOCH2CH2CH2COOH、CH3CHOHCH2COOH、HOCH2CH2CHOHCOOH、HOCH2CH(CH3)COOH,共有4种,
,与C所含官能团种类和数目都相同的同分异构体为:HOCH2CH2CH2COOH、CH3CHOHCH2COOH、HOCH2CH2CHOHCOOH、HOCH2CH(CH3)COOH,共有4种,
故答案为:4;HOCH2CH2CH2COOH(或CH3CHOHCH2COOH、HOCH2CH2CHOHCOOH、HOCH2CH(CH3)COOH).
点评 本题考查有机物的推断,题目难度中等,明确有机物结构与性质为解答关键,注意把握题中信息反应原理,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及逻辑推理能力.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:填空题
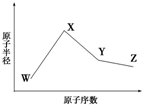 已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定有甲烷和乙烯(C2H4) | ||
| C. | 可能有乙烷(C2H6) | D. | 一定有乙炔(C2H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
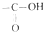 中的-OH被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
中的-OH被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )| A. | CCl4 | B. | CH3COF | C. | CH3COCH2Cl | D. | CH2ClCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,则原溶液一定含有CO32- | |
| B. | 无色溶液中加入 AgNO3溶液,有白色沉淀生成,则原溶液一定含有Cl- | |
| C. | 无色溶液中加入NaOH溶液,加热产生的气体使湿润的红色石蕊试纸变蓝,则原溶液中一定含有NH4+ | |
| D. | 无色溶液中加入BaCl2溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,则原溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丙醇与氧气的混合气体通过赤热的铜,生成丙醛 | |
| B. | 1-丙醇不能和氢卤酸发生反应 | |
| C. | 1-丙醇的沸点低于乙醇 | |
| D. | 1-丙醇、2-丙醇、丙醚互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 石灰氰,是由氰氨化钙(CaCN2)、氧化钙和其他不溶性杂质构成的混合物.呈灰黑色,有特殊臭味.是一种碱性肥料,也是高效低毒多菌灵农药的主要原料之一,可用作除草剂、杀菌剂、杀虫剂等,可用于生产双氰胺、三聚氰胺和氰熔体等.
石灰氰,是由氰氨化钙(CaCN2)、氧化钙和其他不溶性杂质构成的混合物.呈灰黑色,有特殊臭味.是一种碱性肥料,也是高效低毒多菌灵农药的主要原料之一,可用作除草剂、杀菌剂、杀虫剂等,可用于生产双氰胺、三聚氰胺和氰熔体等. )俗称“蛋白精”,也可由氰氨化钙制得.在三聚氰胺分子中含有的σ键和π键数目之比为5:1.
)俗称“蛋白精”,也可由氰氨化钙制得.在三聚氰胺分子中含有的σ键和π键数目之比为5:1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键比范德华力强,所以它属于化学键 | |
| B. | 分子间形成的氢键使物质的熔点和沸点升高 | |
| C. | 由于NH3和H2O之间可形成分子间氢键,使氨在水中溶解度增大 | |
| D. | H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com