
| A. | 氮原子的价电子排布图: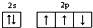 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第VA族,是p区元素 | |
| C. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 | |
| D. | 第一电离能和电负性:1s22s22p4>1s22s22p3 |
分析 A.由洪特规则可知,电子优先占据不同轨道,且自旋方向相同;
B.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,最后填充p电子;
C.原子由基态变成激发态需要吸收能量;
D.同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA、第VA族元素第一电离能大于相邻元素;同一周期中,元素的电负性随着原子序数的增大而增大.
解答 解:A.根据“洪特规则”可知,2p轨道电子的自旋方向应该相同,正确的电子排布图为: ,故A错误;
,故A错误;
B.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,位于第四周期第ⅤA族,最后填充p电子,是p区元素,故B正确;
C.基态Na的电子排布式为1s22s22p63s1,由基态转化成激发态1s22s22p63p1时,电子能量增大,需要吸收能量,故C错误;
D.1s22s22p4和1s22s22p3元分别为O、N元素,同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA、第VA族元素第一电离能大于相邻元素,所以第一电离能大小顺序是:1s22s22p3>1s22s22p4,同一周期中,元素的电负性随着原子序数的增大而增大,所以电负性大小顺序是1s22s22p4>1s22s22p3,故D错误;
故选B;
点评 本题考查原子核外电子的排布、原子核外电子的跃迁以及第一电离能和电负性的比较,题目难度中等,注意同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA、第VA族元素第一电离能大于相邻元素.


科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰的密度比水小 | B. | H2O的分解温度比H2S高得多 | ||
| C. | 液态氟化氢中有三聚氟化氢(HF) | D. | NH3的沸点比PH3高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
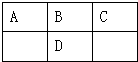 如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )
如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )| A. | H2CO3 | B. | H2SO4 | C. | HNO3 | D. | H3PO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图Ⅰ研究的是t0时升高温度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 | |
| C. | 图Ⅲ研究的是压强对化学平衡的影响,且乙压强大于甲 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com