
X��Y��Z��L��M��N������ԭ���������������ǰ������Ԫ�ء�X��Y��Z��L����ɵ����ʵĻ���Ԫ�أ�M�ǵؿ��к�����ߵĽ���Ԫ�ء�N�ĺ˵������L�ĺ˵������3����2�� �ش��������⣺
��1��X��Y�����γ�10���ӡ�14���ӡ�18���ӷ��ӣ�д��XԪ������������������ȵĺ��صķ��� ����X��YԪ����ɵ�14���ӷ��ӵĵ���ʽΪ ��
��2����ˮ��Һ��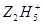 ��Fe3+��ԭΪFe2+��
��Fe3+��ԭΪFe2+��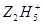 +4Fe3+��4Fe2++�������л�ѧ��Ӧʽ�еIJ������ʼ������Ѹ������÷�Ӧ�����ӷ���ʽΪ______________________________��
+4Fe3+��4Fe2++�������л�ѧ��Ӧʽ�еIJ������ʼ������Ѹ������÷�Ӧ�����ӷ���ʽΪ______________________________��
��3��һ�������£�M��TiO2��C(ʯī)��Ӧֻ����M���������̼����(TiC)�����߾�ΪijЩ���½ṹ�մɵ���Ҫ�ɷ֡���֪���÷�Ӧ����lmol M��������ʱ�ų�536kJ�����������Ȼ�ѧ����ʽΪ ��
��4��ZԪ�ص���̬�⻯�������������Ӧ��ˮ���ﻯ������һ���Σ����ε�ˮ��Һ�� (��ᡱ��������С����ԣ���ˮ��Һ�и�����Ũ����С�����˳�� ��
��5��N�ĵͼ���������Һ��������Ʒ�Ӧ����N�ĵͼ���������������Ƶ����ʵ���֮��Ϊ2��1�������������ɣ���÷�Ӧ�����ӷ���ʽΪ ��
��1��12H H��C C��H��2�� N2H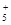 +4Fe3+��4Fe2++N2+5 H+
+4Fe3+��4Fe2++N2+5 H+
��3��4Al(s)+ 3TiO2(s)+3C(s) =" 2Al" 2O3(s)+ TiC(s) ��H= -1072kJ��mol-1
��4���� [OH-]<[H+]<[NH4+]<[NO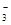 ]
]
��5��3Na2O2 + 6 Fe2++6 H2O ="4" Fe(OH)3��+2 Fe3++6 Na+
�������������M�ǵؿ��к�����ߵĽ���Ԫ�أ�����M��Al��X��Y��Z��L����ɵ����ʵĻ���Ԫ�أ���X��Y��Z��L��M����Ԫ�ص�ԭ������������������X��Y��Z��L�ֱ���H��C��N��O��N�ĺ˵������L�ĺ˵������3����2��Ϊ������1��XԪ������������������ȵĺ��صķ���12H����X��YԪ����ɵ�14���ӷ��ӵĵ���ʽΪ H��C C��H��2����2����ˮ��Һ��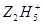 ��Fe3+��ԭΪFe2+��
��Fe3+��ԭΪFe2+��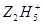 +4Fe3+��4Fe2++����������ԭԭ����֪�÷�Ӧ�����ӷ���ʽΪ_ N2H
+4Fe3+��4Fe2++����������ԭԭ����֪�÷�Ӧ�����ӷ���ʽΪ_ N2H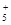 +4Fe3+��4Fe2++N2+5 H+����3������������Ȼ�ѧ����ʽ����д���輴Ϊ 4Al(s)+ 3TiO2(s)+3C(s) =" 2Al" 2O3(s)+ TiC(s) ��H= -1072kJ��mol-1 ����4���������ǿ��������ˮ������ԣ�����Ũ�ȴ�С��ϵΪ [OH-]<[H+]<[NH4+]<[NO
+4Fe3+��4Fe2++N2+5 H+����3������������Ȼ�ѧ����ʽ����д���輴Ϊ 4Al(s)+ 3TiO2(s)+3C(s) =" 2Al" 2O3(s)+ TiC(s) ��H= -1072kJ��mol-1 ����4���������ǿ��������ˮ������ԣ�����Ũ�ȴ�С��ϵΪ [OH-]<[H+]<[NH4+]<[NO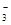 ]��5����������������������������������ԭ��������������ԭ��Ӧԭ����д������ʽΪ3Na2O2 + 6 Fe2++6 H2O ="4" Fe(OH)3��+2 Fe3++6 Na+��
]��5����������������������������������ԭ��������������ԭ��Ӧԭ����д������ʽΪ3Na2O2 + 6 Fe2++6 H2O ="4" Fe(OH)3��+2 Fe3++6 Na+��
���㣺������һ������Ԫ�����ڱ���Ԫ��������֪ʶ���ۺ���Ŀ������Ƕȹ㣬�ѶȽϴ�


 һ����������ϵ�д�
һ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
X��Y��Z��D��E��G���ֶ�����Ԫ�ص�ԭ���������ε�����X��Y��DԪ�صĻ�̬ԭ���е��Ӳ�����δ�ɶԵ���������ȣ�D��E����ͬ��Ԫ�أ�G�ĵ��ʺ�ED2�����������Ư���ԣ�RԪ�ص�M��ȫ����N��ֻ��1�����ӡ�
��ش��������⣺���ö�Ӧ��Ԫ�ط��ű�ʾ��
��1��RԪ����Ԫ�����ڱ�����������______��Ԫ�أ�Y��Z��D����Ԫ���е縺����С�����˳����_________��
��2��X3D+������ԭ���ӻ����������__________�������ӵ����幹���� ��
��3����RED4��ˮ��Һ�м���ZX3��ˮ��Һ���������йط�Ӧ�����ӷ���ʽ�� ��
��4����RG2��ˮ��Һͨ��ED2��������ɫ����RG���÷�Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
X��Y��Z��W��Ԫ�����ڱ���ǰ30��Ԫ�أ���ԭ���������������������Ϣ���±���
| Ԫ�� | �����Ϣ |
| X | Xԭ�ӻ�̬ʱ���������������ڲ����������2�� |
| Y | Y�Ļ�̬ԭ�����������Ų�ʽΪnsnnpn+2 |
| Z | ZԪ�ص���������븺�۴�����Ϊ6 |
| W | W��̬ԭ��δ�ɶԵ�������ǰ30��Ԫ�������� |
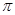 ����ĿΪ ��
����ĿΪ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
A��B��C��D��E��F���ֶ�����Ԫ�أ���ԭ������������������B��Cͬ���ڣ�D��E��Fͬ���ڣ�A��Dͬ���壬C��Fͬ���壬CԪ�ص�ԭ�������������Ǵ�����������������D����������ԭ�Ӱ뾶��������Ԫ�ء���֪����Ԫ�����γɵij��������ڳ��³�ѹ�������������壬�����ǹ��塣
��ش��������⣺
��1��Ԫ��D�����ڱ��е�λ��_______________________��
��2��C��D��F����Ԫ���γɵļ����ӵİ뾶�ɴ�С��˳���ǣ������ӷ��ű�ʾ��___________.
��3����A��B��C����Ԫ����ԭ�Ӹ�����4 ��2 ��3�γɻ�����X��X��������ѧ��������________________.
��4����E�ǽ���Ԫ�أ��䵥������������Ӧ�����ں��Ӹֹ죬��д����Ӧ�Ļ�ѧ����ʽ��____________����E�Ƿǽ���Ԫ�أ��䵥���ڵ��ӹ�ҵ������ҪӦ�ã���д��������������ǿ����Һ�����ӷ���ʽ��________________��
��5��FC2�����ж����ŷŵ����������γ����꣬д��FC2��������ˮ������Ӧ�Ļ�ѧ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ͼΪ�ġ��塢����������Ԫ�ؼ��⻯��е������ڱ仯ͼ�������⻯A��B��C��D��������һ��Ԫ�أ�����ͼ�ش�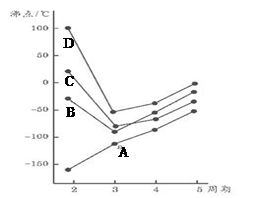
��1��д��B3���Ŀռ乹��
��2��BԪ������һ���⻯����������ȼ�ϣ������ʽΪ��__________________������ԭ���ӻ���ʽΪ_______________
��3��AԪ�������ᄃ������Ϊ____________________���о������������ᄃ���У�A��λ������ʯ������̼ԭ��λ�����ƣ��Է���������ռ����ԭ�Ӹ���ӦΪ___________����
��4��A��B��C��D��һ��������С�����˳����____________________����Ԫ�ط��ű�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪��X��Y��Z��R���ֶ�����Ԫ��ԭ��������������X����̬�⻯��ˮ��Һ�ʼ��ԣ�Yԭ�ӵ�L���������K���������3����Z��R�ĵ�����һ����������ͭ��Ӧ����Cu2Z��CuR2�������Ҫ����ա�
��1������X��ԭ�ӽṹʾ��ͼ ��R����������Ӧˮ����Ļ�ѧʽΪ ��
��2��Y��Z��R����Ԫ����ԭ�Ӱ뾶������ ����Ԫ�ط��ű�ʾ����
��3��X��̬�⻯����Z������������Ӧˮ���ﷴӦ���ɵIJ�����������ѧ��������Ϊ ������ò����������ӵ�ʵ�鷽���� ��
��4��R�ĵ���ͨ�뵽����ʯ��ˮ�з�Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
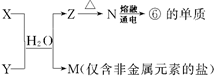
�±�ΪԪ�����ڱ���һ���֣������Ԫ�آ٣����ڱ��е�λ�ã�
�ش��������⣺
| �� ���� | IA | | 0 | |||||
| 1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
| 2 | | | | �� | �� | �� | | |
| 3 | �� | �� | �� | �� | | | �� | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
Ԫ�����ڱ��������о��������ʵ���Ҫ���ߣ��±���Ԫ�����ڱ���һ���֣����û�ѧ����ش��������⣺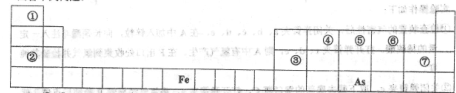
(1)�١��ߺ�Ԫ��ԭ�Ӱ뾶������____������������Ӧ��ˮ������������ǿ����________________.
(2)д���ɢ�-�ߺ�Ԫ���еļ�������Լ��Ե��εĻ�ѧʽ____________________����д��2�ּ��ɣ����������ӷ���ʽ��ʾ����һ���Լ��Ե�ԭ��____________________.
(3)д���ۺ�Ԫ�ص�������������-�ߺ�Ԫ���н�������ǿ��Ԫ�ص�����������ˮ���ﷴӦ�����ӷ���ʽ_____________________��
(4) As��Ԫ�����ڱ��е�λ����________________��
��As��ԭ�ӽṹʾ��ͼΪ________�����⻯��ĵ���ʽΪ___________.
(6)Y���ɢڢޢ�����Ԫ����ɣ�����ˮ��Һ��һ�������г�������������As������Y��ˮ��Һ��Ӧ����������ۺ�����(H3AsO4 )��д���÷�Ӧ�����ӷ���ʽ_____________________,
������1mol��ԭ��ʱת�Ƶ��ӵ����ʵ���Ϊ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
X��Y��Z��W��Ԫ�����ڱ�ǰ�����ڳ���������Ԫ�أ�ԭ��������������X�ĵ��ʼ��ЦҼ��V�Цм�����X�ĵ�һ�����ܱ�������Ԫ�ض���Y�ĵ縺�Ա�X��С�����̬ԭ��������p�����Ǹò�s���ӵ�������Z��ǰ36��Ԫ����ԭ�Ӱ뾶��������Ԫ�أ�W��һ�ֺ��ص���������56����������30��
(1) Yλ��Ԫ�����ڱ���_______���ڵ�_______�壬W2+�ĺ�������Ų�ʽ��______��
(2) X��������XO2��H2O�Ƚϣ��۵�ϸߵ���_______ (�ѧʽ)��Z���⻯������ ���壬Z2O2�Ļ�ѧ��������_______(���ţ�
| A�����Ӽ� | B�����Թ��ۼ� | C���Ǽ��Թ��ۼ� | D�������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com