

分析 (1)装置③干燥氨气选择和氨气不反应、不能溶解氨气的干燥剂;
(2)浓氨水和生石灰两种试剂制备氨气,可以利用浓氨水滴入生石灰中溶解放热一水合氨分解生成氨气,也可以加热氨水生成氨气;装置C为锥形瓶;
(3)NO与氨气反应生成氮气和水;反应中NO中的N元素得电子化合价降低;
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,避免生成的一氧化氮被空气中的氧气氧化;
(5)检验铵根离子用浓的氢氧化钠和湿润的红色石蕊试纸;
(6)防止倒吸;装置⑦是用来检验氨气是否除净的装置,若氨气有剩余,在溶液中会生成沉淀;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成.不能用玻璃棒搅拌,防止胶体聚沉;
②盐酸能被酸性高锰酸钾溶液氧化;
③根据配制溶质质量分数一定的溶液的步骤推出需要的仪器;
④容量瓶没有0刻度线;
⑤CO2、HCl都能和饱和Na2CO3溶液反应;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO32-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子.
解答 解:(1)装置③干燥氨气选择和氨气不反应、不能溶解氨气的干燥剂;
a.浓硫酸和氨气反应,不能干燥氨气,故a不符合;
b.碱石灰是碱性干燥剂,可以干燥氨气,故b符合;
c.无水氯化钙会和氨气结合不能干燥氨气,故c不符合;
故答案为:b;
(2)浓氨水和生石灰两种试剂制备氨气,可以利用浓氨水滴入生石灰中溶解放热一水合氨分解生成氨气,也可以加热氨水生成氨气,反应的化学方程式为:NH3•H2O$\frac{\underline{\;CaO\;}}{\;}$NH3↑+H2O或NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,则可以选择装置B或C,C装置中盛放生石灰的仪器名称是锥形瓶,
故答案为:B或C;锥形瓶;
(3)在加热和催化剂条件下,NO与氨气反应生成氮气和水,其反应的方程式为:6NO+4NH3$\frac{\underline{催化剂}}{△}$5N2+6H2O;反应中NO中的N元素得电子化合价降低,则NO为氧化剂;
故答案为:6NO+4NH3$\frac{\underline{催化剂}}{△}$5N2+6H2O;NO;
(4)利用稀硝酸和碳酸钙反应生成二氧化碳气体充满试管,把装置中的空气排净,可以避免生成的一氧化氮被空气中的氧气氧化;
故答案为:产生二氧化碳排尽装置中的空气,防止氧化NO;
(5)检验铵根离子先加浓的氢氧化钠,产生的氨气再用湿润的红色石蕊试纸检验;
故答案为:湿润的红色石蕊;
(6)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;
故答案为:防倒吸;⑦中溶液变浑浊;
(7)①制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故①错误;
②盐酸能被酸性高锰酸钾溶液氧化,产生干扰,应该稀硫酸酸化,故②错误;
③配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,所以用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管,玻璃棒搅拌、量筒量取浓溶液、烧杯稀释浓溶液,胶头滴管定容,故③正确;
④容量瓶没有0刻度线,故④错误;
⑤CO2、HCl都能和饱和Na2CO3溶液反应,应该用饱和碳酸氢钠除去二氧化碳中的氯化氢,故⑤错误;
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾,氯化氢遇水蒸气生成盐酸小液滴,故⑥正确;
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO32-也可能含有碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以样品中不一定含有碳酸根离子,故⑦错误;
故选③⑥.
点评 本题考查了物质性质的实验验证和反应现象的判断应用,注意掌握常见气体的制备原理和方法以及常见物质的检验方法,题目难度中等,侧重于考查学生的实验探究能力和对基础知识的综合应用能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu $\stackrel{稀HNO_{3}}{→}$Cu(NO3)2 | |
| B. | Cu $\stackrel{Cl_{2}}{→}$CuCl2 $\stackrel{NaOH溶液}{→}$Cu(OH)2 $\stackrel{稀HNO_{3}}{→}$ Cu(NO3)2 | |
| C. | Cu $\stackrel{O_{2}}{→}$CuO$\stackrel{稀HNO_{3}}{→}$ Cu(NO3)2 | |
| D. | Cu $\stackrel{浓H_{2}SO_{4}}{→}$CuSO4 $\stackrel{Ba(NO_{3})_{2}溶液}{→}$ Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -CHO的电子式: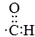 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 乙烯的结构简式为:CH2CH2 | D. | 丙烷分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:K+、Cl-、NO3-、Fe3+ | |
| B. | 能使甲基橙显红色的溶液:CO32-、Na+、Cl-、SO42- | |
| C. | pH=1的溶液中:Mg2+、SO42-、Fe2+、Cu2+ | |
| D. | 能使铝钝化的溶液中:Ba2+、Na+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 2:15 | C. | 2:11 | D. | 1:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L N2和NH3混合气体中原子间共有3NA个共用电子对 | |
| B. | 3.0 g甲醛HCHO和乙酸混合物中共含碳原子数为0.1NA | |
| C. | 25℃时pH=1的醋酸溶液中含有H+的数目为0.1NA | |
| D. | 标准状况下,2.24 L CH2Cl2含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
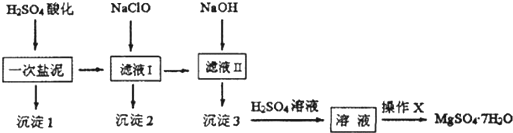
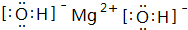 (写电子式).
(写电子式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com