
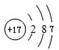
 ,D微粒的结构示意图是
,D微粒的结构示意图是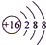 ,写出E的三种核素11H、21H、31H.
,写出E的三种核素11H、21H、31H. 分析 有A、B、C、D、E五种单核微粒:
①当A微粒失去3个电子后,电子层结构与氖原子的相同,则A为Al;
②B微粒得到一个电子后,其电子层结构与氩原子相同,则B为Cl;
③C微粒是带两个单位正电荷,核电荷数为12的阳离子,则C为Mg2+;
④D微粒18个电子,带两个单位的负电荷,则D为S2-;
⑤E微粒不带电,原子核中只有一个质子,则E为H原子.
解答 解:(1)有A、B、C、D、E五种单核微粒:
①当A微粒失去3个电子后,电子层结构与氖原子的相同,则A为Al;
②B微粒得到一个电子后,其电子层结构与氩原子相同,则B为Cl;
③C微粒是带两个单位正电荷,核电荷数为12的阳离子,则C为Mg2+;
④D微粒18个电子,带两个单位的负电荷,则D为S2-;
⑤E微粒不带电,原子核中只有一个质子,则E为H原子,
故答案为:Al;Cl;Mg2+;S2-;H;
(2)B微粒的结构示意图是 ,D微粒的结构示意图是
,D微粒的结构示意图是 ,E的三种核素为11H、21H、31H,
,E的三种核素为11H、21H、31H,
故答案为: ;
; ;11H、21H、31H.
;11H、21H、31H.
点评 本题考查了原子核外电子排布及质子数、中子数、质量数的相互关系等知识点,侧重考查学生对基础知识的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 生成的乙酸乙酯中含有18O | B. | 生成的水分子中不含18O | ||
| C. | 可能生成44g乙酸乙酯 | D. | 可能生成90g乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应时构成分子的原子种类发生改变 | |
| B. | 分子、原子、离子都是构成物质的微粒 | |
| C. | 不同元素最本质的区别在是相对原子质量不同 | |
| D. | 原子不显电性,是因为原子中不存在带电的粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维--Si | B. | 熟石灰--CaO | ||
| C. | 水煤气--CO、H2 | D. | 绿矾--Fe2(SO4)3•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
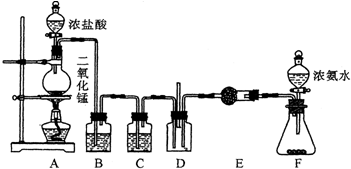
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol•L-1•s-1 | B. | v(A2)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(B2)=0.42 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH3OH | CH3OCH3 | H2O |
| t1 | 0.8 | 1.24 | 1.24 |
| t2 | 0.08 | 1.6 | 1.6 |
| A. | 平衡后升高温度,平衡常数>400 | |
| B. | t2时刻反应达到平衡状态 | |
| C. | 平衡时,反应混合物的总能量减少20kJ | |
| D. | 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com