
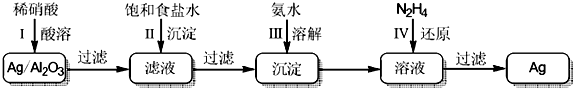
分析 在Ag/A12O3中加稀硝酸生成硝酸银,过滤,在滤液中加饱和食盐水,生成氯化银沉淀,过滤,滤渣为AgCl,把AgCl溶解在氨水中,然后加N2H4还原得到Ag;
(1)Ag与稀硝酸反应生成硝酸银和NO;
(2)除去工业食盐水中的少量Na2SO4、MgC12、CaC12杂质,先加碳酸钠、再加氯化钡,NaOH可前可后,过滤后,然后加盐酸;
(3)AgCl溶于氨水生成银氨络离子;
(4)银氨溶液中加N2H4,N2H4具有还原性,氧化产物为N2,还原产物为Ag,根据反应判断产物;
(5)根据盖斯定律把已知方程式转化为目标方程式,然后计算反应热;
(6)碱性条件下,Ag2O2在正极上得电子生成Ag和氢氧根离子;
(7)第Ⅰ、Ⅱ、Ⅲ步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,则Ag的质量为a×b%×90%×90%×90%=7.29ab×10-4kg,结合反应中物质之间的关系计算.
解答 解:在Ag/A12O3中加稀硝酸生成硝酸银,过滤,在滤液中加饱和食盐水,生成氯化银沉淀,过滤,滤渣为AgCl,把AgCl溶解在氨水中,然后加N2H4还原得到Ag;
(1)第Ⅰ步中,载体A12O3不与稀硝酸反应,Ag与稀硝酸反应生成硝酸银和NO;故答案为:NO;
(2)除去工业食盐水中的少量Na2SO4、MgC12、CaC12杂质,先加碳酸钠除去CaC12、再加氯化钡除去Na2SO4和多余的碳酸钠,NaOH用于除去MgC12可前可后,只有顺序在过滤操作之前即可,过滤后,然后加盐酸,所以操作顺序为:abdce或badce或bdace;
故答案为:abdce或badce或bdace;
(3)AgCl溶于氨水生成银氨络离子,其反应的离子方程式为:AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O;
故答案为:AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O;
(4)银氨溶液中加N2H4,N2H4具有还原性,氧化产物为N2,还原产物为Ag,反应方程式为:4[Ag(NH3)2]Cl+N2H4=4Ag+N2+4NH4Cl+4NH3,则产物除Ag和N2外,还有的物质是NH4Cl、NH3;
故答案为:NH4Cl、NH3;
(5)N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol①
2NO(g)+O2(g)=2NO2(g)△H=-116kJ/mol②
N2(g)+O2(g)=2NO(g)△H=+183kJ/mol③
根据盖斯定律:①×2-②-③得:2N2H4(1)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135 kJ/mol;
故答案为:2N2H4(1)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135 kJ/mol;
(6)碱性条件下,Ag2O2在正极上得电子生成Ag和氢氧根离子,其电极反应式为Ag2O2+2H2O+4e-=2Ag+4OH-;
故答案为:Ag2O2+2H2O+4e-=2Ag+4OH-;
(7)第Ⅰ、Ⅱ、Ⅲ步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,则Ag的质量为a×b%×90%×90%×90%=7.29ab×10-4kg,已知4[Ag(NH3)2]Cl+N2H4=4Ag+N2+4NH4Cl+4NH3,
则 4Ag~~~~~~~~N2H4
4×108 32
7.29ab×10-4kg m(N2H4)
所以m(N2H4)=$\frac{7.29ab×1{0}^{-4}kg×32}{108×4}$=5.4×l0-4abkg;
故答案为:5.4×l0-4ab.
点评 本题主要考查了工艺流程图、物质的性质、制备实验方案的设计方法,题目难度较大,明确制备流程及相应的反应原理为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
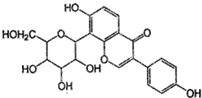
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 一定条件下1mol 该物质与浓溴水反应最多能消耗3mol Br2 | |
| D. | 一定条件下1mol 该物质与H2反应最多能消耗7mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.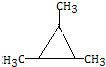 .
.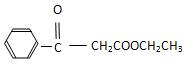
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 操作 | 现象 | 结论 |
| A | 在盛番茄汤的玻璃杯中加入适量植物油,充分搅拌、静置 | 上层溶液颜色比下层更深 | 番茄色素在植物油中的溶解度比在水中小 |
| B | 向浓度均为0.1mol/L的醋酸和硼酸的溶液中分别滴加等浓度Na2CO3溶液 | 前者产生大量气泡,后者无现象 | 酸性强弱顺序:醋酸>碳酸>硼酸 |
| C | 将碳酸氢铵分解产生的气体通入CaC12溶液 | 产生白色沉淀 | CO2与CaC12溶液反应生成CaCO3沉淀 |
| D | 在试管中将某有机物与银氨溶液混合微热 | 产生光亮的银镜 | 该有机物一定是醛类物质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
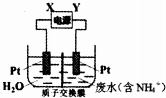
| A. | 直流电源中X为负极 | |
| B. | 阳极反应为2NH4+-6e-=N2↑+8H+ | |
| C. | 阴极反应为2H2O+2e-=H2↑+2OH- | |
| D. | 当有6mol电子转移时,质子交换膜两侧电解质溶液质量变化差为32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.0gSiO2晶体中存在的共价键总数为2 NA | |
| B. | 1L 0.1mol•L-1的Na2CO3溶液中含有阳离子的总数为2NA | |
| C. | 标准状况下,2.0gD2O中含有的质子数和中子数均为NA个 | |
| D. | 室温时,pH=12的Ba(OH)2溶液中,氢氧根离子数目为10-2N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中C的氢化物稳定性最强 | |
| B. | 同周期元素中A的金属性最强 | |
| C. | 原子半径:A>B,离子半径:A+>C- | |
| D. | A、B、C的简单离子中,会破坏水的电离平衡的是C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的原子序数一定为a+2 | |
| B. | Y离子的结构示意图可表示为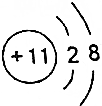 | |
| C. | 若b-a=6.则X和Y形成的化合物一定为离子化合物 | |
| D. | X有可能是非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com