
【题目】向0.1mol·L-1的 NH4HCO3溶液中逐渐加入0.1mol·L-1NaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量与起始物质的量比值)。根据图像,下列说法不正确的是
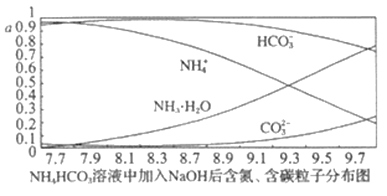
A. 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-=HCO3-+H2O
B. 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C. pH=9.5时,溶液中c(HCO3-)>c(NH3·H2O)>c(NH4+)>c(CO32-)
D. 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH===(NH4)2CO3+Na2CO3
【答案】D
【解析】
试题NH4HCO3溶液中存在NH4+的水解平衡,即NH4++H2O![]() HN3H2O+H+①;HCO3-的水解平衡,即HCO3-+H2O
HN3H2O+H+①;HCO3-的水解平衡,即HCO3-+H2O![]() H2CO3+OH-②;HCO3-的电离平衡,即HCO3-
H2CO3+OH-②;HCO3-的电离平衡,即HCO3-![]() H++CO32-③;A.在未加氢氧化钠时,溶液的pH=7.7,呈碱性,则上述3个平衡中第②个HCO3-的水解为主,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3-的量略有增加,即逆方向的反应是H2CO3+OH-═HCO3-+H2O,故A正确;B.对于平衡①,氢氧根与氢离子反应,平衡正向移动,HN3H2O的量增加,NH4+被消耗,当pH大于8.7以后,CO32-的量在增加,平衡③受到影响,HCO3-被消耗,即碳酸氢根离子和铵根离子都与氢氧根离子反应,故B正确;C.从图中可直接看出pH=9.5时,溶液中c(HCO3-)>c(HN3H2O)>c(NH4+)>c(CO32-),故C正确;D.滴加氢氧化钠溶液时,HCO3-的量并没减小,反而增大,说明首先不是HCO3-与OH-反应,而是NH4+先反应,即NH4HCO3+NaOH═NaHCO3+NH3H2O,故D错误;故选D。
H++CO32-③;A.在未加氢氧化钠时,溶液的pH=7.7,呈碱性,则上述3个平衡中第②个HCO3-的水解为主,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3-的量略有增加,即逆方向的反应是H2CO3+OH-═HCO3-+H2O,故A正确;B.对于平衡①,氢氧根与氢离子反应,平衡正向移动,HN3H2O的量增加,NH4+被消耗,当pH大于8.7以后,CO32-的量在增加,平衡③受到影响,HCO3-被消耗,即碳酸氢根离子和铵根离子都与氢氧根离子反应,故B正确;C.从图中可直接看出pH=9.5时,溶液中c(HCO3-)>c(HN3H2O)>c(NH4+)>c(CO32-),故C正确;D.滴加氢氧化钠溶液时,HCO3-的量并没减小,反而增大,说明首先不是HCO3-与OH-反应,而是NH4+先反应,即NH4HCO3+NaOH═NaHCO3+NH3H2O,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】如图 a、b、c、d均为铂电极,供选择的电解质溶液如下表。要满足条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等。则应选用的电解液是
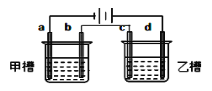
组 | A | B | C | D |
甲槽 | KCl | NaCl | NaOH | Cu(NO3)2 |
乙槽 | AgNO3 | NaNO3 | CuSO4 | NaCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒沙特列原理解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.棕红色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器:①漏斗、②冷凝管、③蒸馏烧瓶、④玻璃棒、⑤分液漏斗、⑥锥形瓶,其中蒸馏操作不需要的仪器是( )
A.①③④B.①②⑥C.①④⑤D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为________________。
(2)A可与溴的四氯化碳溶液反应,其化学方程式为____________________,该反应类型为_______。
(3)已知:![]()
![]()
![]() 。则A与稀、冷的KMnO4溶液在碱性条件下反应的过程可表示:_____________。
。则A与稀、冷的KMnO4溶液在碱性条件下反应的过程可表示:_____________。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式__________________。
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列六组物质:属于同系物的是_________,属于同分异构体是_________,属于同种物质的是___________。(填序号)

(2)下列实验设计或操作合理的是_______________。
a.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯;
b.只用水就能鉴别苯、硝基苯、乙醇;
c.实验室通过浓硫酸与乙醇反应制取乙烯时,必须将温度计的水银球插入反应液中,测定反应液的温度;
d.将电石与饱和食盐水反应后,直接通入酸性KMnO4溶液检验是否得到乙炔。
(3)按要求书写:
①乙炔的电子式______;②  的系统命名为___________________。
的系统命名为___________________。
③相对分子质量为72且沸点最低的烷烃的结构简式___________________;
④某单烯烃的相对分子质量为84,若该分子内所有碳原子均在同一平面内,则其结构简式为_______________。
⑤C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是( )
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=1048.9 kJ·mol-1
A. ΔH4﹦2ΔH32ΔH2ΔH1
B. O2(g)+2H2(g)![]() 2H2O(l) ΔH5,ΔH5>ΔH3
2H2O(l) ΔH5,ΔH5>ΔH3
C. 1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g)
D. 联氨和N2O4作火箭推进剂的原因之一是反应放出大量的热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究铁发生腐蚀的装置图,下列说法正确的是

A. 若B处液面上升,A溶液可能是酸性溶液
B. 若A为NaCl溶液,B、C液面始终保持不变
C. 可能产生Fe2O3·nH2O
D. 腐蚀的总反应式一定是:2Fe + O2 + 2H2O === 2Fe(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com