
【题目】已知25℃时:①HF(aq)+OH-(aq)![]() F-(aq)+H2O(l) ΔH=-67.7 kJ/mol
F-(aq)+H2O(l) ΔH=-67.7 kJ/mol
②H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol下列有关说法中正确的是( )
A.HF电离:HF(aq)![]() H+(aq)+F-(aq)△H=+10.4KJ/mol
H+(aq)+F-(aq)△H=+10.4KJ/mol
B.水解消耗0.1 mol F-时,吸收的热量为6.77 kJ
C.中和热均为57.3 kJ/mol
D.含1 mol HF、1 mol NaOH的两种溶液混合后放出的热量为67.7 kJ
【答案】B
【解析】
A、利用盖斯定律将①②可得HF(aq)![]() F(aq)+H+(aq) ΔH=10.4kJmol1,故A错误;
F(aq)+H+(aq) ΔH=10.4kJmol1,故A错误;
B、依据反应的热化学方程式,HF(aq)+OH(aq)![]() F(aq)+H2O(1) ΔH=67.7kJ/mol,得到F(aq)+H2O(1)
F(aq)+H2O(1) ΔH=67.7kJ/mol,得到F(aq)+H2O(1)![]() HF(aq)+OH(aq) ΔH=+67.7kJ/mol,水解消耗0.1molF-时,吸收的热量为6.77kJ,故B正确;
HF(aq)+OH(aq) ΔH=+67.7kJ/mol,水解消耗0.1molF-时,吸收的热量为6.77kJ,故B正确;
C、中和热是强酸强碱的稀溶液全部反应生成1mol水放出的热量,弱酸弱碱或浓溶液反应,中和热不是57.3kJ/mol,故C错误;
D、HF是弱酸,电离过程依据A分析可知是放热,则含1molHF、1molNaOH的两种溶液混合后放出的热量大于67.7kJ,故D错误。


科目:高中化学 来源: 题型:
【题目】如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。液体A和气体B的组合不可能是( )

A. 氢氧化钠溶液、一氧化氮
B. 水、氨气
C. 氢氧化钠溶液、二氧化碳
D. 水、二氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:

(1)指出提取碘的过程中有关的实验操作名称:①____________________;③______________________。写出实验②中有关反应的离子方程式___________________________________________。
(2)提取碘的过程中,可供选择的有关试剂是___________。
A. 甲苯、酒精 B. 四氯化碳、苯 C. 汽油、乙酸 D. 汽油、甘油
(3)为使海带中I-转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器。还缺少的仪器是________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出下图实验装置中的错误之处:①_________________②___________________③___________________。

(5)进行上述蒸馏操作时,使用水浴的原因是___________;最后,晶态碘在___________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并常有刺激性气味的气体产生,实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:

请回答下列问题:
(1)装置f的作用是____________
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为____________。
(3)蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因:_______________________________________________________
(4)下列四种制备SO2的方案中最佳选择是____。

(5)装置e中产生的Cl2经过装置d后进入三颈烧瓶, d中所用的试剂为_______。(按气流方向)
(6)实验结束后,将三颈烧瓶中混合物分离开的实验操作是________(己知SCl2的沸点为50℃)。若反应中消耗Cl2的体积为896 mL(己转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为__________(保留三位有效数字)。
(7)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种常见的非金属元素A与B,与常见的三种金属元素C、D、E,A的一种单质是自然界硬度最大的物质,B与C的单质在加热条件下反应生成淡黄色化合物X,D的单质既能与盐酸、也能与NaOH溶液反应生成H2。E的单质在B的单质中燃烧火星四溅,生成一种黑色固体Y。请回答下列问题:
(1)物质X的名称__________________。![]()
![]()
![]()
(2)将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因_____________________
(3)写出E的单质与H2O加热时反应的化学方程式,并用单线桥分析电子转移的方向和数目:________________________________________________________。
(4)ag C的单质投入足量CuSO4溶液中,下列实验现象正确的有__________________。
A.钠沉在溶液底部 B.熔化成银色光亮的小球
C.小球四处游动发出”嘶嘶”的声音 D.生成红色固体物质
可能的离子方程式为___________________________________________________。将所得沉淀过滤、洗涤、灼烧,可得到___________g固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象的效果,下列表达不正确的是( )
A. NaOH溶液与SO2反应时溶液中溶质的情况 ![]()
B. NaAlO2溶液与盐酸反应后铝的存在形式![]()
C. Fe在Cl2中燃烧产物![]()
D. Fe和稀硝酸反应后,铁的存在形式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有K+、Mg2+、Fe3+、Al3+、Fe2+、Cl-、CO32-、OH-、SiO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.20mol·L-1(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:
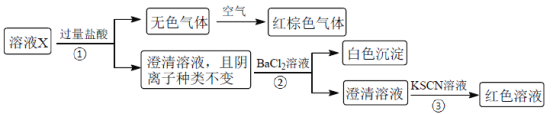
下列说法正确的是
A.无色气体可能是NO和CO2的混合物
B.由步骤③可知,原溶液肯定存在Fe3+
C.溶液X中所含离子种类共有4种
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com