
分析 用太阳能电解水可获得最理想的单质燃料X为H2,把X转变成便于运输的甲醇燃料,将空气通过极浓的NaOH溶液中,此时空气中的Y有70%被吸收转变为正盐Z为Na2CO3,Y为CO2、Z为Na2CO3;CO2与氢气反应生成甲醇;
(1)水分解得到的可燃气体为H2;故X为氢气;空气中能被NaOH吸收的气体为CO2,即Y为CO2、Z为Na2CO3;CO2与氢气反应生成甲醇;
(2)Ⅰ中发生的反应为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),是气体体积减小的反应;Ⅱ中发生的反应为气体体积不变的反应.
①n=2.5时,I中气体初始物质的量为:2.5 mol+6.5 mol+2 mol+2 mol=13 mol,Ⅱ中气体的物质的量恒为12 mol.如要是隔板停留在中间,左侧反应应向正反应方向移动,以使气体体积得到12 mol.要使反应向正方向进行,左侧气体的初始物质的量应大于12 mol,故:n mol+10.5 mol>12 mol,即n>1.5,同时还要求,当CO2或H2完全转化为产物时,气体总物质的量应小于12 mol,若CO2完全转化,生成CH3OH和H2O物质的量均为6.5 mol,已经大于12 mol,故应为氢气完全转化时,气体总物质的量小于12 mol;
②当n取值3.0和4.0时,反应达平衡时总物质的量均为12 mol时,反应的转化率不同,反应温度不同,故平衡时A的物质的量不同.
解答 解:(1)水分解得到的可燃气体为H2;故X为氢气;空气中能被NaOH吸收的气体为CO2,即Y为CO2、Z为Na2CO3;CO2与氢气反应生成甲醇,CO2+3H2O=CH3OH+H2O,
故答案为:Na2CO3;CO2+3H2O=CH3OH+H2O;
(2)①n=2.5时,I中气体初始物质的量为:2.5 mol+6.5 mol+2 mol+2 mol=13 mol,Ⅱ中气体的物质的量恒为12 mol.如要是隔板停留在中间,左侧反应应向正反应方向移动,以使气体体积得到12 mol.要使反应向正方向进行,左侧气体的初始物质的量应大于12 mol,故:n mol+10.5 mol>12 mol,即n>1.5,同时还要求,当CO2或H2完全转化为产物时,气体总物质的量应小于12 mol,若CO2完全转化,生成CH3OH和H2O物质的量均为6.5 mol,已经大于12 mol,故应为氢气完全转化时,气体总物质的量小于12 mol,故有:6.5 mol-n mol/3+4 mol+2n mol/3<12 mol,n<4.5.n的取值范围为1.5<n<4.5,
故答案为:正反应;1.5<n<4.5;
②当n取值3.0和4.0时,反应达平衡时总物质的量均为12 mol时,反应的转化率不同,反应温度不同,故平衡时A的物质的量不同,
故答案为:不相等、温度不同.
点评 本题考查了好像平衡的计算、平衡影响因素分析、注意容器的特征和改变条件对平衡的影响的判断,气体压强之比等于气体物质的量之比,题目难度中等.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:实验题
 实验室合成乙酸乙酯如(如图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是(78.5℃、118℃、77.1℃)
实验室合成乙酸乙酯如(如图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是(78.5℃、118℃、77.1℃)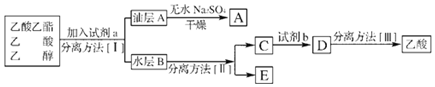
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:填空题
查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4?(绿色)、Cr2O72?(橙红色)、CrO42?(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于_______________(选填编号)。
a.主族元素 b.副族元素 c.Ⅷ族元素 d.过渡元素
(2)铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;与Ni等添加到Fe中可制成不锈钢。比较硬度:纯铁_________不锈钢;熔点:纯铁__________不锈钢(填“>”“<”或“=”)。
(3)Cr(OH)3与Al(OH)3的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是___________________。
(4)CrO42?和Cr2O72?在溶液中可相互转化。室温下,初始浓度为1.0 mol·L?1的Na2CrO4溶液中c(Cr2O72?)随c(H+)的变化如图所示。
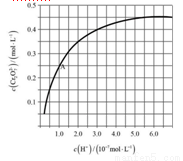
①用离子方程式表示Na2CrO4溶液中的转化反应____________________。
②由图可知,溶液酸性增大,CrO42?的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42?的平衡转化率减小,则该反应的ΔH__________0(填“>”“<”或“=”)。
(5)+6价铬的化合物毒性较大,但其化合物用途广泛。如:“酒精检测仪”可检查司机是否酒驾,其反应原理为:m C2H5OH+ n X + p H2SO4═ g Cr2(SO4)3 + w CO2↑+ 9H2O,其中X的化学式最有可能为__________。常用NaHSO3将酸性废液中的Cr2O72?还原成Cr3+,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol/L | B. | 2.0mol/L | C. | 1mol/L | D. | 2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | HClO═H++ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2的比例模型: | |
| B. | 甲烷的电子式 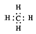 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子构成${\;}_6^{12}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和Na2CO3溶液除去CO2中混有的HCl气体 | |
| B. | 用量筒量取20.83mL12mol/L的浓硫酸配制250mL1mol/L稀硫酸 | |
| C. | 用浓硫酸干燥CO2、SO2、HI等酸性气体 | |
| D. | 用稀HNO3能鉴别Mg、Na2CO3、NaAlO2、Na2SiO3四种固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com