
| A. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| B. | CO2、CH4、N2等均是造成温室效应的气体 | |
| C. | 节能减排符合低碳经济的要求 | |
| D. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
分析 A.酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体形成的,使用清洁能源减少了二氧化硫、氮氧化物的排放;
B.氮气不能引起温室效应;
C.根据低碳经济的要求判断;
D.开发利用可燃冰为我国在新世纪使用高效新能源开辟了广阔的前景.
解答 解:A.酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体形成的,使用清洁能源减少了二氧化硫、氮氧化物的排放,所以使用清洁能源是防止酸雨发生的重要措施之一,故A正确;
B.CO2、CH4等均是造成温室效应的气体,氮气不能引起温室效应,故B错误;
C.节能减排可以减少CO2的排放,符合低碳经济的要求,符合可持续发展战略,故C正确;
D.可燃冰为我国在新世纪使用高效新能源开辟了广阔的前景,合理开发利用可燃冰有助于缓解能源紧缺,故D正确;
故选B.
点评 本题考查环境保护、能源利用问题,是社会关注的焦点问题,熟悉生活中常见的环境污染与治理知识是解题关键,题目难度不大.


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
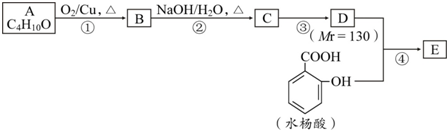

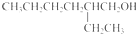 .
.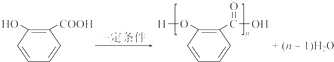 .
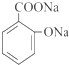
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
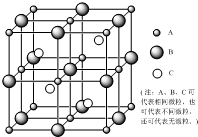 晶体的世界丰富多彩,晶体的结构纷繁复杂.人教版课程标准高中教材《选修3》向我们展示了一些典型晶体的结构及性质的相关知识,如:干冰、冰、金刚石、石墨、钋、钾、镁、铜、NaCl、CsCl、CaF2.下图是一个立方晶胞图,请大家在上述所列物质范围内回答下列问题:
晶体的世界丰富多彩,晶体的结构纷繁复杂.人教版课程标准高中教材《选修3》向我们展示了一些典型晶体的结构及性质的相关知识,如:干冰、冰、金刚石、石墨、钋、钾、镁、铜、NaCl、CsCl、CaF2.下图是一个立方晶胞图,请大家在上述所列物质范围内回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
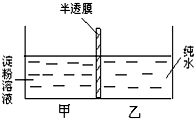 已知如图装置的甲、乙两室内装入液体的体积相同.请回答下列问题:
已知如图装置的甲、乙两室内装入液体的体积相同.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与甲烷发生取代反应,是制取二氯甲烷的有效方法 | |
| B. | 红热的铁丝、铜丝都能在氯气里剧烈燃烧,生成大量白色的烟 | |
| C. | 氯气和次氯酸钠都可用于杀菌、消毒,使用时要注意用量 | |
| D. | 聚氯乙烯是使用量非常大,应用领域最为广泛的塑料,也是熟、热食品常用的包装材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
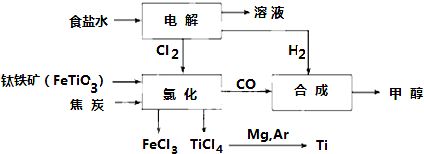
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| X | 所有元素中原子半径最小的元素 |
| Y | 地壳中含量最多的元素 |
| Z | 短周期中原子半径最大的金属元素 |
| M | 与Y同主族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com