
| A. | 单位时间内消耗的A与生成的B物质的量之比为1:3 | |
| B. | 混合物各物质浓度的浓度相等 | |
| C. | 容器内A、B、C三种物质共存 | |
| D. | ν(A)、ν(B)、ν(C) 之比为1:3:3 |
分析 可逆反应A(g)+3B(g)?3C(g)达到平衡状态时,正反应速率与逆反应速率相等,各组分的浓度、百分含量不再发生变化,据此对各选项进行判断.
解答 解:A.单位时间内消耗的A与生成的B物质的量之比为1:3,表明正逆反应速率相等,一定达到平衡状态,故A正确;
B.达到平衡状态时,各组分的浓度不再变化,但其浓度不一定相等,故B错误;
C.对应可逆反应,无论是否达到平衡状态,反应物、生成物一定同时存在,所以容器内A、B、C三种物质共存时不一定达到平衡状态,故C错误;
D.反应速率与化学计量数成正比,无论是否达到平衡状态,ν(A)、ν(B)、ν(C) 之比都是为1:3:3,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意掌握化学平衡及其影响因素,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 136C和146C | B. | CH3CH2CH2CH3和CH3CH(CH3)CH3 | ||
| C. | 红磷和白磷 | D. | 甲烷和乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
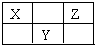 X、Y、Z三种短周期元素在周期表中的位置如图所示.若X的最高正价与负价的代数和为2,则下列说法正确是( )
X、Y、Z三种短周期元素在周期表中的位置如图所示.若X的最高正价与负价的代数和为2,则下列说法正确是( )| A. | 原子序数由大到小为 Z>Y>X | |
| B. | 氢化物最稳定的元素为Z | |
| C. | 最高价氧化物的水化物酸性最强的元素为Z | |
| D. | 原子半径由大到小为 Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA | |
| B. | 1mol Na2CO3晶体中含CO32-离子数小于NA | |
| C. | 惰性电极电解食盐水,若线路中通过NA个电子,则阳极产生气体标况下11.2L | |
| D. | 0.1mol的CaO2中含阴离子数是0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
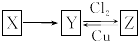 X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com