
| A. | 原子半径为次序为W>Y>Z | B. | Y、W形成的化合物水溶液显碱性 | ||
| C. | 对应氢化物的稳定性:Y>Z | D. | W与X、Y、Z均能形成离子化合物 |
分析 X-的电子层结构与氦相同,X应为H元素,Y、Z原子次外层电子数均为8,应为第三周期元素,最外层电子数之和为13,则Y应为S元素,Z应为Cl元素,X、W同主族,则W为K元素,以此解答该题.
解答 解:X-的电子层结构与氦相同,X应为H元素,Y、Z原子次外层电子数均为8,应为第三周期元素,最外层电子数之和为13,则Y应为S元素,Z应为Cl元素,X、W同主族,则W为K元素,
A.K原子核外有4个电子层,原子半径最大,同周期元素从左到右原子半径逐渐减小,则原子半径为次序为W>Y>Z,故A正确;
B.硫化钾为强碱弱酸盐,水解呈碱性,故B正确;
C.非金属性Cl>S,元素的非金属性越强,对应的氢化物越稳定,故C错误;
D.K为活泼金属,可分别为H、S、Cl形成离子化合物,故D正确.
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构的关系推断各元素为解答的关键,注意元素周期律的应用,题目难度不大.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题
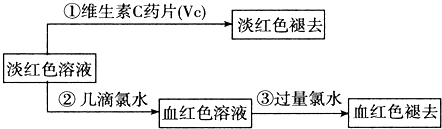
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .已知有机物X的键线式为
.已知有机物X的键线式为 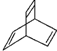 ,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )
,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )| A. | Y的结构简式为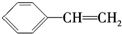 | |
| B. | Y能使溴水褪色,且反应后的混合液静置后不分层 | |
| C. | Y不能发生取代反应 | |
| D. | Y分子中的所有原子一定共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙酸和乙醇的混合液注入浓硫酸中制备乙酸乙酯 | |
| B. | 将铜丝在酒精灯外焰上加热变黑后再移至内焰,铜丝恢复原来的红色 | |
| C. | 在试管中注入2 mL CuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀生成 | |
| D. | 向苯酚溶液中滴加几滴稀溴水出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度能减慢反应速率 | |
| B. | 单质碳的颗粒变小能加快反应速率 | |
| C. | 增大H2O蒸气的浓度能加快反应速率 | |
| D. | 加入足量的C能使H2O反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上利用电解法冶炼铝和铁 | |
| B. | 生产和生活中常用可溶性铝盐和铜盐净水 | |
| C. | 工业合成氨的反应属于能自发进行的反应,故能迅速发生 | |
| D. | 热的纯碱溶液清洗带油污的餐具与盐类和酯类的水解均有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com