
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( ) A.Cl2+2KBr ===Br2+2KCl
B.2NaHCO3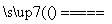 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.2Na2O2+2CO2===2Na2CO3+O2
科目:高中化学 来源: 题型:
葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
 煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种
 脱硫技术的原理为FeS2 Fe2++SO42—
脱硫技术的原理为FeS2 Fe2++SO42—
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
第二步反应的离子方程式为____________________。
(3)工业煤干馏得到的产品有焦炭、________。
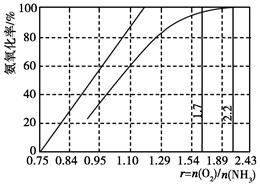
(4 )工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是________________________________________。
)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+__________→__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
| |
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
含金属元素的离子一定都是阳离子
在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从游离态变为化合态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式是:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
⑴反应中 元素被氧化, 是氧化剂。
⑵请标出电子转移的方向和数目。 2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
⑶反应产物中,氧化产物与还原产物的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是 ( )
①向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫红色 ②向FeCl2溶液中加入氯水,再加入KSCN溶液呈红色 ③向KMnO4溶液中加入浓盐酸后,振荡后紫色褪去
A.I2>Cl2>Fe3+>MnO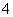 B.MnO
B.MnO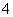 >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
C.Cl2>I2>Fe3+>MnO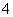 D.Fe3+>MnO
D.Fe3+>MnO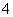 >Cl2>I2
>Cl2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑ 还原反应:MnO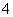 +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:________________________________________。
(2)该反应中氧化剂是________,被氧化的元素是________;若有0.5 mol H2O2参加此反应,则转移电子个数为________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为
;这时若有0.5 mol H2O2发生分解,则转移电子个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)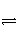
 1/2N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
1/2N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com