
| A. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| B. | 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.01 NA | |
| C. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 标准状况下,NA个CO2分子占有的体积为22.4 L |
分析 A.标况下水是液体;
B.1mol碳酸钠含有2mol钠离子;
C.溶液体积未知;
D.气体摩尔体积22.4L/mol使用条件是标准状况;
解答 解:A.标况下水是液体,22.4 L H2O物质的量大于1mol,故A错误;
B.1.06 g Na2CO3物质的量为$\frac{1.06g}{106g/mol}$=0.01mol,含有钠离子个数为0.01mol×2×NA=0.02NA,故B错误;
C.溶液体积未知,无法计算溶液中氯离子数目,故C错误;
D.标准状况下,NA个CO2分子物质的量为1mol,占有的体积为22.4 L,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确物质的量、粒子数、质量、体积等与阿伏加德罗常数关系是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中加入少量固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+cOH-) | |
| B. | pH=9的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1mol•L-1CH3COOH溶液与0.05mol•L-1NaOH溶液等体积混合:2c(H+)+c((CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.85g | B. | 7.78g | C. | 6.72g | D. | 6g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
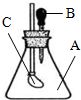 如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起.则对于气体A和液体B最可能的是( )
如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起.则对于气体A和液体B最可能的是( )| A. | A是Cl2,B是饱和NaCl溶液 | B. | A是NH3,B是酚酞溶液 | ||
| C. | A是H2,B是水 | D. | A是CO2,B是NaHCO3饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol•L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol•L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(l)=Zn(g)△H=$\frac{1}{2}$(△H1-△H2) | |
| B. | 用硅制作的太阳能电池是将化学能转化为电能 | |
| C. | 增加 Zn(g)的量,△H2变大 | |
| D. | Zn-Cu-CuSO4溶液构成的原电池中,Cu片质量增加,Zn片质量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com