

| 沉淀物 | AI(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |


科目:高中化学 来源: 题型:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省珠海市高三上学期期末质检理综化学试卷(解析版) 题型:实验题
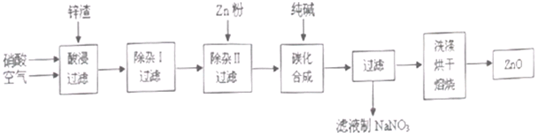
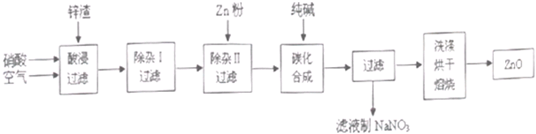
现从锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如下:

有关氢氧化物完全沉淀的pH见下表:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
6.7 |
8.0 |
(l)在酸浸过程中,要提高锌元素的浸出率,可以采取 措施。
(2)上述流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(3)在“除杂I”步骤中,将溶液调至pH=4的目的是 。在“除杂II”后,溶液的pH约为6,则此步过滤时滤渣中含有 。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式 。
(5)从滤液中提取NaNO3晶体的操作步骤为 。
(6)在实验室如何洗涤过滤出的碱式碳酸锌? 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | AI(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源:珠海一模 题型:问答题
| 沉淀物 | AI(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com