
| A. | SO2和SO3都是极性分子 | |
| B. | 在NH4+和H3O+中都存在配位键 | |
| C. | 元素电负性越大的原子,吸引电子的能力越强 | |
| D. | 原子晶体中原子以共价键结合,普遍具有熔点高硬度大的特性 |
分析 A.根据分子的空间构型判断;
B.含有孤电子对和含有空轨道的原子之间易形成配位键;
C.非金属性越强,电负性越大,该元素的原子吸引电子的能力越强;
D.根据原子晶体物理性质分析.
解答 解:A.SO2中S原子的价层电子对数为2+$\frac{6-2×2}{2}$=3,含有一个孤电子对,分子构型为V形,属于极性分子,SO3中S原子的价层电子对数为3+$\frac{6-2×3}{2}$=3,没有孤电子对,空间结构为平面三角形,分子结构对称是非极性分子,故A错误;
B.H3O+中O原子与H+形成配位键,NH4+中N与H+之间形成配位键,故B正确;
C.非金属性越强,电负性越大,该元素的原子吸引电子的能力越强,故C正确;
D.原子晶键能大、熔点高、硬度大是因为原子之间以共价键结合,共价键键能大,熔化时要破坏共价键,故D正确;
故选A.
点评 本题考查了分子极性的判断、配位键、电负性、原子晶体的性质,题目考查知识点较多,但是较基础,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| B. | 根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等 | |
| C. | 镁铝合金、漂白粉、水玻璃、王水均为混合物 | |
| D. | 纯碱、熟石灰、醋酸、食盐水均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广碳捕集和储存技术,逐步实现 CO2的零排放 | |
| B. | 乙醇不能用于消毒杀菌 | |
| C. | 用 Na2S 除去工业废水中的 Cu2+离子 | |
| D. | 晶体硅可用于制造太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
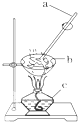 海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.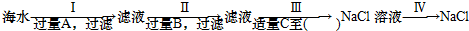
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| C. | 过氧化钠固体与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向氢氧化钠溶液中通入足量的CO2气体:CO2+2OH-═CO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com