

| A. | t1时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂 | |
| B. | 反应达到平衡时,外界条件对平衡影响关系如图所示,若b=1,a为正整数,则P1<P2 | |
| C. | 从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A、B一定是气体,D一定不是气体,C可能不是气体 |
分析 A.若a+b=c,改变的条件可能为增大压强;
B.若b=1,a为正整数,则增大压强,平衡正向移动;
C.由图可知,反应从正向开始,T2为平衡状态,升高温度,B的含量增大;
D.降温,正反应速率大于逆反应速率,正反应为放热反应;加压,正反应速率大于你反应速率,则A、B是气体、C、D有一种为固体或液体符合平衡正向移动.
解答 解:A.若a+b=c,改变的条件可能为增大压强,则不一定为催化剂,故A错误;
B.若b=1,a为正整数,则增大压强,平衡正向移动,G的体积分数减小,则P1<P2,故B正确;
C.由图可知,反应从正向开始,T2为平衡状态,升高温度,B的含量增大,平衡逆向移动,则正反应为放热反应,故C错误;
D.降温,正反应速率大于逆反应速率,正反应为放热反应;加压,正反应速率大于你反应速率,则A、B是气体、C、D有一种为固体或液体符合平衡正向移动.故D错误.
故选B.
点评 本题考查化学平衡与图象,明确坐标及图象中的点、线、面,明确影响反应速率及化学平衡的因素是解答的关键,侧重学生分析图象解决问题的能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑤ | C. | ①⑤⑥ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.
为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
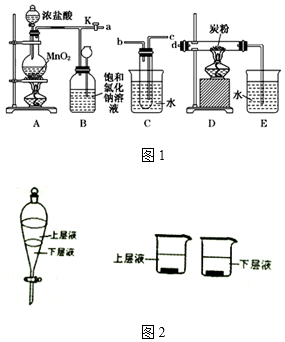
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ?
? (g)+H2(g)△H=+124kJ•mol-1
(g)+H2(g)△H=+124kJ•mol-1| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
 +Cl2(g)?
+Cl2(g)? +HCl(g)△H2>0
+HCl(g)△H2>0
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  从KI和I2的固体混合物中回收I2 | |
| B. |  除去乙醇中的苯酚 | |
| C. |  实验用CCl4提取溴水中的Br2 | |
| D. |  配制100mL 0.1000mol•L-1 K2Cr2O7溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com