
| A、①=②>③>④ |
| B、④>②>③>① |
| C、②>①=③>④ |
| D、①>③>④>② |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、浓硝酸和稀硝酸都具有强氧化性 |
| B、干燥的氯气无漂白性,液氯具有极强的漂白性 |
| C、火山喷发产生的火山灰中不可能含有SO3气体 |
| D、高温下SiO2与Na2CO3反应生成Na2SiO3和CO2,证明硅酸酸性强于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,8g甲烷(CH4)中含有的碳原子数为NA |
| B、标准状况下,0.3mol CO2中含有氧原子数为0.3NA |
| C、1mol Na与足量水反应后转移的电子数为NA |
| D、1mol?L-1 MgCl2溶液中Cl-离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
| B、NO2与水的反应:3NO2+H2O═2NO3-+NO+2H+ |
| C、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、稀硝酸与锌粒反应:Zn+2H+═Zn+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol H2O的质量为18g/mol |
| B、标准状况下,1mol任何物质体积均为22.4L |
| C、3.01×1023个SO2分子的质量为32g |
| D、CH4的摩尔质量为16g |
查看答案和解析>>
科目:高中化学 来源: 题型:
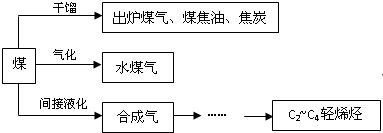
查看答案和解析>>
科目:高中化学 来源: 题型:
| 使用方法 | 开袋即食,或用微波炉加热1分钟后食用 |
| 部分配料 | ①小麦淀粉 ②棕榈油 ③食盐 ④柠檬黄 |
| 生产日期 | 见封口或喷码 |
| 保质期 | 12个月 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com