
| A. | 核外电子排布相同的微粒,其化学性质也相同 | |
| B. | 含有金属元素和非金属元素的化合物不一定是离子化合物 | |
| C. | 仅含非金属元素的化合物一定是共价化合物 | |
| D. | 凡需要加热的反应一定是吸热反应 |
分析 A.核外电子排布相同的微粒,其化学性质不一定相同;
B.含有金属元素和非金属元素的化合物不一定是离子化合物,可能是共价化合物;
C.仅含非金属元素的化合物可能是离子化合物;
C.需要加热的反应不一定是吸热反应,可能是放热反应.
解答 解:A.核外电子排布相同的微粒,其化学性质不一定相同,如Na+和F-,故A错误;
B.含有金属元素和非金属元素的化合物不一定是离子化合物,可能是共价化合物,如氯化铝,故B正确;
C.仅含非金属元素的化合物可能是离子化合物,如铵盐,故C错误;
C.需要加热的反应不一定是吸热反应,可能是放热反应,如铝热反应,故D错误;
故选B.
点评 本题考查较综合,涉及化合物与化学键关系、吸热反应和放热反应等知识点,侧重考查基本概念、基本理论,注意不能根据是否含有金属元素判断离子键,易错选项是BC.


科目:高中化学 来源: 题型:解答题
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有NaBr溶液(试管①)和KI溶液(试管②)中,用力振荡后加入少量四氯化碳,振荡,静置 | 写出试管②中的实验现象 溶液分层下层为紫红色 | 写出试管①中的离子方程式: Cl2+2Br-=2Cl-+Br2 |
| 2.将少量溴水加入盛有KI溶液(试管③)中,用力振荡后加入少量四氯化碳,振荡,静置 | 现象略 | 写出试管③中的离子方程式: Br2+2I-=2Br-+I2 |
| 实验结论: 元素非金属性由强到弱的顺序为:Cl>Br>I. | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
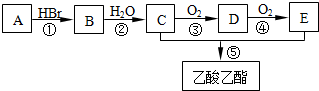
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何晶体中都存在化学键 | |
| B. | 晶体内部的微粒在空间的排列均服从紧密堆积原理 | |
| C. | 任何晶体中,若有阴离子必定含有阳离子 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
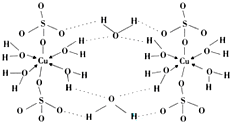 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
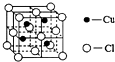 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.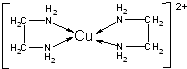
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
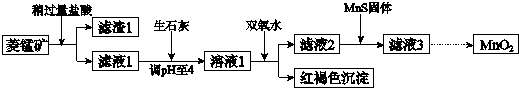
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、甲苯、硝基苯 | B. | 苯、苯酚、己烯 | ||
| C. | 苯、甲苯、环己烷 | D. | 苯酚、硫氰化钾溶液、氢氧化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com