
 NH3·H2O+H+ (2) < (3) Cl- NH4+ (4)=
NH3·H2O+H+ (2) < (3) Cl- NH4+ (4)= NH3·H2O+H+
NH3·H2O+H+

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源:不详 题型:单选题
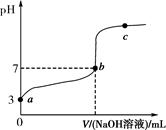
| A.a与b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| C.b点时,V(NaOH溶液)=20 mL,且c(CH3COO-)=c(Na+) |
D.a、b、c点表示的溶液中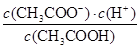 均相等 均相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.均存在电离平衡和水解平衡 | B.存在的粒子种类相同 |
| C.c(H+)前者小于后者 | D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(K+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| B.c(K+)+ c(S2-) = 0.3mol/L |
| C.c(K+)=c(S2-)+c(HS-)+c(H2S) |
| D.c(OH-)=c(H+)+c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)>c(HSO3-)>c(H+)>c(OH-) |
| B.c(Na+) = c(HSO3-)+2c(SO32-)+c(H2SO3) |
| C.c(OH-)+c(SO32-)=c(H2SO3)+c(H+) |
| D.c(Na+)+c(H+)=c(HSO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.硫化钠水解 S2-+2H2O H2S+2OH- H2S+2OH- |
B.硫氢化钠的水解 HS-+H2O H3O++S2- H3O++S2- |
C.不断加热煮沸氯化铁溶液 Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3+3H+ |
| D.硫酸铝溶液跟NaHCO3溶液反应 Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com