
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑩ | |
| 4 | ⑨ |
 ,酸性最强的物质为高氯酸,化学式为:HClO4,
,酸性最强的物质为高氯酸,化学式为:HClO4, ;HClO4;
;HClO4;| 2 |
| 3 |
| 4.8g |
| 32g/mol |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
| A、100℃时,纯水中c(H +)=1×10-6mol?L-1,此时纯水显酸性 | ||
| B、25℃时,pH=10的氨水与pH=4盐酸等体积混合,所得溶液呈酸性 | ||
| C、25℃时,将pH=a的醋酸溶液稀释10倍后,溶液的pH=b,则b=(a+1) | ||
D、25℃时,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中O点代表氢元素.下列说法中正确的是( )| A、离0点越远的元素原子半径越大 |
| B、虚线相连的元素处于同一族 |
| C、B、C最高价氧化物的水化物不能相互反应 |
| D、A、B组成的化合物中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向盛有苯酚溶液的试管中滴入FeCl3溶液,溶液呈紫色 |
| B、淀粉溶液遇碘离子变蓝 |
| C、氨气能使湿润的蓝色石蕊试纸变红 |
| D、二氧化硫能使石蕊溶液变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
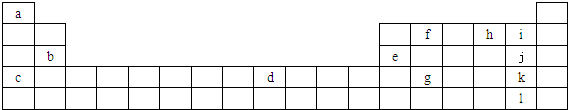
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫元素有多种化合价,可形成多种化合物.
硫元素有多种化合价,可形成多种化合物.| ① | ||
|
| ②加入足量氯水 |
| 同时加过量BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
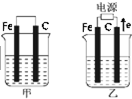 I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是
I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com