
【题目】下列措施对增大反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:

已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,物质①4 g H2 ,② 33.6L CH4 ,③1mol H2O ,④3.01×1023 个 O2
(1)质量最大的是_____(填序号,下同);
(2)分子数最多的是_____;
(3)原子数最少的是_____;
(4)体积最小的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色能源是指使用过程中不排放或排放极少污染物的能源,如一次能源中的水能、地热能、天然气等;二次能源中的电能、氢能等。下列能源属于绿色能源的是
①太阳能②风能③石油④煤⑤潮汐能⑥木材
A.①②③B.③④⑤C.④⑤⑥D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
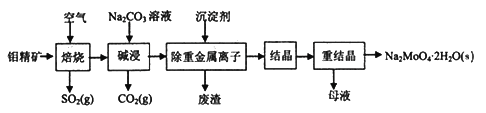
回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为_________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2(H2O)2] 3+的几何异构体种数有(不考虑光学异构)___________种。
(3)金属钴是由______键形成的晶体;CoO、FeO的晶体结构类型均与氯化钠的相同,Co2+和Fe2+的离子半径分别为74.5pm和78pm,则熔点CoO______FeO。
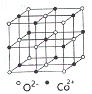
(4)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿佛加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定.我国科技工作者研制出以铝合金、Pt﹣Fe合金网为电极材料的海水电池.在这种电池中①铝合金是阳极 ②铝合金是负极 ③海水是电解液 ④铝合金电极发生还原反应( )
A.②③
B.②④
C.①②
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大。X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子。回答下列问题:
(1)Y、Z、T中单质熔点最高是______(填元素符号)
(2)比W原子序数少5的基态原子中单电子数为_________________。
(3)T与Z形成的化合物中,中心原子杂化类型是_______
(4)X和上述其他元素中的一种形成的化合物中:分子呈三角锥形的是________(填化学式);分子中既含有极性共价键,又含有非极性共价键的化合物是_______(填化学式,写一种)。
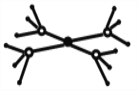
(5)这5种元素形成的一种阴阳离子个数比为1:1型的配合物中,阴离子呈四面体结构,阳离子的结构如图所示。该配合物的化学式为__________,阳离子中存在的化学键类型有_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com