

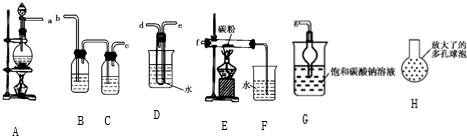
分析 (1)B的作用是防止倒吸,应该选用装置乙;C装置的作用是检验二氧化硫的漂白性,可用洗气装置;
(2)装置乙也具有防止倒吸的作用;
(2)浓硫酸与锌反应生成硫酸锌、二氧化硫气体和水,有二氧化硫生成能证明浓硫酸具有强氧化性;
(3)随反应进行浓H2SO4变成稀H2SO4,锌与稀硫酸反应生成氢气.
解答 解:(1)B的作用是防止倒吸,装置乙为安全瓶,具有防止倒吸的作用;C装置的作用是检验二氧化硫的漂白性,可用洗气装置,可将甲填入C中,且为长进短出,所以正确的连接顺序为:a接3(或4),4(或3)接b,c接1,2接d,
故答案为:3或4;4或3; 1; 2;
(2)D、E试管中CCl4溶液的作用是防止溶液倒吸,装置乙为安全瓶,也能够防止倒吸,
故答案为:乙;
(3)浓硫酸与锌反应的化学方程式为:Zn+2H2SO4=ZnSO4+SO2↑+2H2O,有二氧化硫生成能证明浓硫酸具有强氧化性,C中品红溶液同时,证明生成了二氧化硫,从而证明浓硫酸具有强氧化性,
故答案为:C中品红溶液褪色;
(4)随反应的进行浓H2SO4变成稀H2SO4,稀硫酸与Zn反应放出H2,所以生成气泡量又会明显增加,
故答案为:浓H2SO4变成稀H2SO4,稀硫酸与Zn反应放出H2.
点评 本题考查了浓硫酸的性质、二氧化硫的检验方法,题目难度中等,注意掌握锌与浓硫酸的反应原理,本题中注意锌能够浓硫酸、稀硫酸反应,明确实验目的及基本操作方法为解答关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、NO、NaH、N2 | |
| B. | SO2、N${\;}_{2}^{+}$、N${\;}_{3}^{-}$、CNO- | |
| C. | CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、BeCl2 | |
| D. | SiF4、SiO${\;}_{4}^{4-}$、SO${\;}_{4}^{2-}$、PO${\;}_{4}^{3-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:
草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
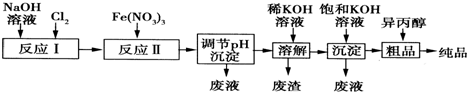
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com