
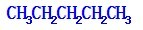 ;
;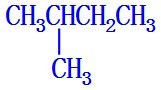 ;
; .
.分析 (1)FeCl3溶液常用于刻蚀印刷电路板是铜与三价铁离子反应,该反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价;
(2)由方程式可知,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+;
(3)Cu被氧化,根据负极反应为Cu-2e-=Cu2+计算转移电子的物质的量;
(4)根据电池反应式知,Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Cu作负极,不如铜活泼的金属或导电的非金属作正极,如C,FeCl3溶液为电解质溶液;
(5)氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水;
(6)根据同分异构体书写方法减碳法书写同分异构体,其中一氯代物只有一种的结构即为只有一种氢原子的有机物,与氯气在光照条件下发生取代反应解.
解答 解:(1)FeCl3溶液常用于刻蚀印刷电路板是铜与三价铁离子反应,该反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,总反应离子方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)由方程式可知,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,故答案为:2Fe3++2e-=2Fe2+;
(3)Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,根据反应知,转移电子的物质的量=$\frac{4.8}{64}×2$=0.15mol,故答案为:0.15mol;
(4)根据电池反应式知,Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Cu作负极,不如铜活泼的金属或导电的非金属作正极,如C,FeCl3溶液为电解质溶液,其装置图为 ,故答案为:
,故答案为: ;
;
(5)氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水,负极反应式为H2-2e-+2OH-═2H2O,故答案为:H2-2e-+2OH-═2H2O;
(6)根据同分异构体书写方法,写出最长的碳链: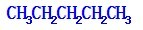 ,拿下1个碳原子作为支链:
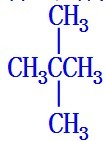
,拿下1个碳原子作为支链: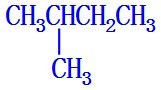 ,拿下2个碳原子作为支链:
,拿下2个碳原子作为支链: ;其中一氯代物只有一种的结构为
;其中一氯代物只有一种的结构为 ,与氯气反应方程式为;C(CH3)4+Cl2$\stackrel{光照}{→}$(CH3)3CCH2Cl+HCl,
,与氯气反应方程式为;C(CH3)4+Cl2$\stackrel{光照}{→}$(CH3)3CCH2Cl+HCl,
故答案为: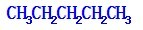 ;
;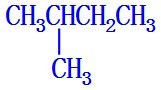 ;
; ;C(CH3)4+Cl2$\stackrel{光照}{→}$(CH3)3CCH2Cl+HCl.
;C(CH3)4+Cl2$\stackrel{光照}{→}$(CH3)3CCH2Cl+HCl.
点评 本题考查了原电池基本原理和设计,电极方程式的书写,有机物的同分异构体等基本知识,这些新课标要求学生需要掌握的内容,正确判断原电池正负极材料、电解质溶液是设计原电池难点,一般来说,还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液;同分异构体采用减碳法书写.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发新能源,减少对化石能源的依赖 | |
| B. | 将燃煤进行脱硫处理,可减少酸雨的形成 | |
| C. | 雾霾(颗粒直径为2.5 x103 nm)具有丁达尔效应 | |
| D. | 推广使用电动汽车,可减少城市雾霾的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| B. | 正极反应式为O2+2H2O+4e-═4OH- | |
| C. | 随着不断放电,电解质溶液碱性不变 | |
| D. | 甲烷燃料电池也可以用稀硫酸做电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与D可形成含18e-的离子化合物 | |
| B. | B单质在C单质中燃烧生成原子个数比为1:1的化合物 | |
| C. | D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | |
| D. | D与E组成的化合物中,各原子最外层均达到8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
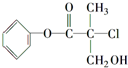 某有机物A是农药生产中的一种中间体,其结构简式如图所示.
某有机物A是农药生产中的一种中间体,其结构简式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表中,主族元素所在的族序数等于原子核外电子数 | |
| B. | 元素周期表有18个族 | |
| C. | ⅠA族的元素不全都是金属元素 | |
| D. | 短周期指的是一、二、三、四周期 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com