
 (1)在恒温、恒容容器中发生反应:2SO2 + O2
(1)在恒温、恒容容器中发生反应:2SO2 + O2 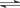 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,O2浓度为2mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 ,达平衡时与反应前压强之比为 。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,O2浓度为2mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 ,达平衡时与反应前压强之比为 。
(2)右图表示在密闭容器中反应:2SO2+O2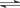 2SO3 △H <0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a 时刻改变条件后达到平衡,新平衡的平衡常数比a时刻前平衡常数 (填“增大”、“减小”或“不变”);b c过程中改变的条件可能是 ; 若增大压强时,反应速率变化情况画在c~d处.
2SO3 △H <0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a 时刻改变条件后达到平衡,新平衡的平衡常数比a时刻前平衡常数 (填“增大”、“减小”或“不变”);b c过程中改变的条件可能是 ; 若增大压强时,反应速率变化情况画在c~d处.
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
有关糖类物质的叙述中正确的是( )
A.糖类物质又叫碳水化合物,其分子式都符合Cn(H2O)m
B.由碳、氢、氧三种元素组成的有机物都属于糖类
C.葡萄糖是最甜的糖
D.糖类一般是多羟基醛、多羟基酮和它们的脱水缩合物
查看答案和解析>>
科目:高中化学 来源: 题型:
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现进行下列两个实验:(N2O4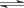 2NO2 △H > 0)
2NO2 △H > 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4A(g)+5B(g) 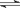 4C(g)+6D(g) △H<0,在一定温度下达到化学平衡状态时,下列说法正确的是
4C(g)+6D(g) △H<0,在一定温度下达到化学平衡状态时,下列说法正确的是
A.2 v( C)正=3v(D)逆
B. 若升高温度最终能生成更多的C和D
C. 单位时间里有4n mol A消耗,同时有5n mol B生成
D. 容器里A、B、C、D的浓度比一定是4:5:4:6
查看答案和解析>>
科目:高中化学 来源: 题型:
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(含Fe2O3.SiO2.Al2O3等)转变成重要的工业原料FeSO4(反应条件略)
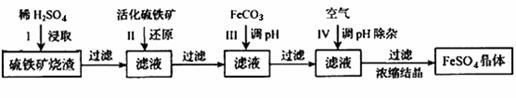
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2( SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第II步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第III步加FeCO3调溶液pH=6时,利用相关数据计算,判断Al3+是否沉淀完全? (填“是”或“否”)(已知Ksp【Al(OH)3】=1.9×10-33,当离子浓度小于1×10-5mol·L-1时,可认为沉淀完全)
(4)FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) 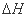 = —1648kJ/mol
= —1648kJ/mol
C(s)+O2(g)=CO2(g) 
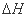 = —393kJ/mol
= —393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) 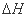
 = —1480kJ/mol
= —1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得F eS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li + FeS2 = Fe + 2Li2S,正极反应式是
eS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li + FeS2 = Fe + 2Li2S,正极反应式是 
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
0.6mol的Cu2S与足量的稀HNO3反应,生成物为Cu(NO3)2、H2SO4、NO、H2O,则参加反应的被还原和未被还原的硝酸的物质的量分别为( )
A.0.6mol、0.3mol B.1.2mol、0.6mol
C.2mol、0.6mol D.2mol、2.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里做钠跟水反应的实验时,用到的仪器和药品是
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤烧杯 ⑥ 石棉网⑦ 玻璃片 ⑧药匙
A.①②③④ B.②③④⑤⑦
C.①③④⑥⑧ D.②⑤⑥⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com