
| A�� | һ�������£�1molN2��3molH2��ַ�Ӧ���������е�N-H����ĿΪ6NA | |
| B�� | 9.2g ��NO2��N2O4��ɵĻ�����к�����ԭ�ӵ���ĿΪ 0.2NA | |
| C�� | ��ȫȼ��1.5molCH3CH2OH��C2H4�Ļ���ת�Ƶ�����Ϊ18NA | |
| D�� | 1L 0.1 mol•L-l��Na2S��Һ��S2-��HS-������Ϊ0.1NA |
���� A���ϳɰ��ķ�ӦΪ���淴Ӧ��
B��NO2��N2O4����NO2���ɣ�
C��1molCH3CH2OH��1molC2H4ȼ��ʱ������3mol������
D��S2-�������������Һ�л�ˮ��ΪHS-��H2S��
��� �⣺A���ϳɰ��ķ�ӦΪ���淴Ӧ���ʲ��ܽ��г��ף������ɵ�N-H������С��6NA������A����
B��NO2��N2O4����NO2���ɣ���9.2g������к��е�NO2�����ʵ���Ϊn=$\frac{9.2g}{46g/mol}$=0.2mol���ʺ�0.4mol��ԭ�Ӽ�0.4NA������B����
C��1molCH3CH2OH��1molC2H4ȼ��ʱ������3mol��������1.5mol���������4.5mol��������������Ӧ���Ϊ-2�ۣ���4.5mol����ת��18mol���Ӽ�18NA������C��ȷ��
D��S2-�������������Һ�л�ˮ��ΪHS-��H2S����S2-��HS-��H2S��������Ϊ0.1NA������D����
��ѡC��
���� ���⿼���˰���٤���������йؼ��㣬�������չ�ʽ��ʹ�ú����ʵĽṹ�ǽ���ؼ����ѶȲ���


 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH2CH2CH3��CH3CH��CH3��2����̼���칹 | |
| B�� | 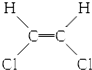 �� ��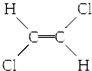 ����λ���칹 ����λ���칹 | |
| C�� | CH2�TC��CH3��2��CH3CH�TCHCH3���ڹ������칹 | |
| D�� | CH3CH2CH2COOH��CH3COOCH2CH3����λ���칹 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 46g�Ҵ��д��ڵĹ��ۼ�����Ϊ7NA | |
| B�� | 1mol�״���ȫȼ��ʱ��ת�Ƶĵ�����Ϊ6NA | |
| C�� | ��״���£�22.4L�����22.4L�ȷ������е�������ΪNA | |
| D�� | 1 L 0.1mol/L������Һ�к��е���������Ϊ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
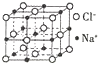 ��C��N��O��Na��Fe����Ԫ����ɵ������Na2[Fe��CN��5��NO��]���������Ƹ�Ѫѹ��֢��
��C��N��O��Na��Fe����Ԫ����ɵ������Na2[Fe��CN��5��NO��]���������Ƹ�Ѫѹ��֢���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
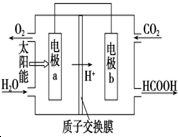 ȼ�ϵ�ʹ�úͷ���Ⱦ����ᷢչ��һ�����رܵ�ì�ܻ��⣮
ȼ�ϵ�ʹ�úͷ���Ⱦ����ᷢչ��һ�����رܵ�ì�ܻ��⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ��ѧʽ | ����ʽ���еĻ�ѧ������ | ���ʵ����� | ���������Ӧ����; |
| A | NaClO | ���Ӽ������ۼ� | ǿ������ | ����Һ |
| B | H2O2 | 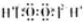 | ���ȶ����ֽ� | ҽ�������� |
| C | NH3 | ���ۼ� | ˮ��Һ�������� | ��ҵ������ |
| D | NaHCO3 | ���Ӽ� | �����ֽ� | ��ĭ����� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
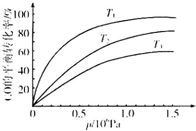 �����仯�������ճ����������Ӧ�ù㷺���о������仯�����Ӧ�������شش��������⣺
�����仯�������ճ����������Ӧ�ù㷺���о������仯�����Ӧ�������شش��������⣺| �¶� | 250�� | 600�� | 1000�� | 2000�� |
| ��Ҫ�ɷ� | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x��CO�� | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �������� | �Ʊ�ԭ�� | ��ѧ���� |
| ��ɫ��״Һ�壬�۵�Ϊ-40�棬�е�Ϊ71�棬��������ˮ���������л��ܼ����ܶ�Ϊ1.65g/mL | Cl2��NH4Clˮ��Һ�ڵ����·�Ӧ | 95�汬ը����ˮ�з���ˮ�� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
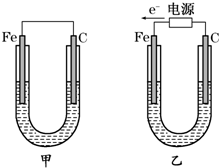
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com