
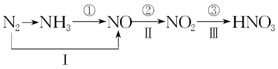
 工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.
工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.分析 (1)反应①是氨气的催化氧化反应生成一氧化氮和水;
(2)A.赤潮的形成是因为人类生产生活产生的大量污水排放使得海水中氮、磷等营养物质的含量突然增加,造成海水富营养化;
B.行驶的汽车大量排放含氮氧化物、一氧化碳、碳氢化合物等废气,在强烈的日光作用下,这些排放物发生光化反应,生成二次污染物.这是一种浅蓝色、有刺激性的烟雾--光化学烟雾;
C.造成臭氧空洞的物质的氟氯代烃;
D.造成温室效应的气体是二氧化碳;
E、二氧化硫、氮氧化物的排放会形成酸雨;
(3)铜和硝酸反应生成硝酸铜与氮的氧化物(NO或NO2或NO、NO2的混合物),反应中硝酸其氧化剂、酸性作用,起氧化剂作用的硝酸生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒:2n[Cu(NO3)2]+n(NO、NO2),据此计算消耗硝酸的物质的量.
解答 解:(1)反应①是氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)(2)A.造成赤潮的物质是N、P化合物,故A错误;
B.光化学烟雾,是城市大气中的碳氢化合物(HC)和氮氧化合物(NOx)在阳光紫外线的作用下发生的一系列链式大气化学反应生成以臭氧(O3)为代表的刺激性二次污染物,与NO2有关,故B正确;
C.引起臭氧空洞的主要原因是一种叫“氟利昂”的物质破坏了平流层大气中的臭氧,故C错误;
D.造成温室效应的气体是二氧化碳,而不是二氧化氮,故D错误;
E、酸雨是因为二氧化硫、氮氧化物的排放,以及一些工业气体的排放,与二氧化氮的排放有关,故E正确;
故答案为:BE;
(3)12.8gCu的物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,气体的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,
根据氮原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol,
故答案为:0.65mol.
点评 本题考查了环境污染、氮氧化物性质分析、硝酸的性质及氧化还原反应计算,明确物质的性质是解本题关键,注意保护环境,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | X的气态简单氢化物的热稳定性比W的强 | |
| B. | 由Y、Z两种元素组成的化合物是离子化合物 | |
| C. | W的氧化物可与Z的最高氧化物对应水化物反应 | |
| D. | 粒子半径的大小顺序:r(W)>r(X)>r(Z+)>r(Y3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钾、硫黄、木炭粉末混合制成的火药爆炸 | |
| B. | 从青蒿中萃取出青蒿素 | |
| C. | “以曾青涂铁,铁赤色如铜”的湿法炼铜 | |
| D. | 碳酸锌与金属铜通过煅烧炼制黄铜(铜铸合金) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
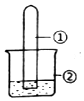 用图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | NH3 | AlCl3溶液 | 产生白色沉淀 |
| D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Fe3+有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| B | 浓硫酸有腐蚀性 | 常温下浓硫酸不能用铁罐盛装 |
| C | Cl2是非金属单质 | Cl2能使湿润的有色布条褪色 |
| D | 熔融状态的Al2O3中有自由移动的Al3+和O2- | 电解熔融状态的Al2O3制备Al |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天津港爆炸事故救援过程中,消防员若发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| B. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,说“纳米铜”的还原性比铜片更强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子方程式 | 评价 |
| A | 将2molCl2通入到含1molFeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2, | 正确;Cl2过量,可将Fe2+、I-均氧化 |
| B | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO3-+OH-=MgCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素可形成两种以上的盐 | |
| B. | Y、Z、M的氢化物中,M的氢化物最稳定 | |
| C. | 四种元素中原子半径最大的为M | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,则C的燃烧热为110.5kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4kJ/mol | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com