
【题目】[化学一选修3: 物质结构与性质] 钾、碘、铁元素对人体的健康起到至关重要的作用,回答下列问题:
(1)基态K 原子核外有______种不同运动状态的电子,有_____种不同形状的电子云,价电子排布式是__________________。
(2)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于____晶体。
(3)赤铁盐(K3[Fe(CN)6])主要用于制药、电镀等工业,其煅烧分解生成KCN、(CN)2等物质。
①(CN)2中存在碳碳键,则分子中含有___个σ键,___个π键。
②KCN与盐酸作用产生HCN,则HCN中心原子C的杂化轨道类型__________________。
(4)KIO3晶体是一种性能良好的非线型光学材料,具有钙钛矿型的立体结构。
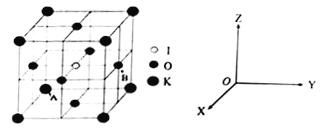
①已知A离子坐标参数为(0,0,0),则B离子的坐标参数________________。
②若KIO3晶胞参数为a纳米(nm)、阿伏伽德罗常数为NA,则该晶体密度为_____g·cm-3(列出计算式即可)。
③若碘原子处在各顶点位置,则钾离子和氧原子在晶胞中的位置分别是_______、___________。
【答案】 19 2 4s1 分子 3 4 sp ![]()
![]() 体心 棱(心)
体心 棱(心)
【解析】试题分析:(1)原子核外有几个电子就有几种运动状态;S、P能级电子云形状不同;钾原子第四层上的电子是价电子;(2)根据Fe(CO)5的熔、沸点较低分析;(3) ①(CN)2中存在碳碳键,结构式为![]() ;②HCN分子的结构式是:H-C≡N,HCN分子中含有2个σ键和2个π键,C原子不含孤电子对,所以价层电子对数是2;(4)①根据晶胞结构分析B离子的坐标;②根据均摊原则计算晶胞的摩尔质量,根据
;②HCN分子的结构式是:H-C≡N,HCN分子中含有2个σ键和2个π键,C原子不含孤电子对,所以价层电子对数是2;(4)①根据晶胞结构分析B离子的坐标;②根据均摊原则计算晶胞的摩尔质量,根据![]() 计算密度;③根据晶胞结构分析;
计算密度;③根据晶胞结构分析;
解析:(1) (1)基态K原子核外有19个电子,所以原子核外有19种运动状态的电子;S、P能级电子云形状不同,K原子核外有2种不同形状的电子云;钾原子第四层上的电子是价电子,价电子排布式是4s1;(2) Fe(CO)5的熔、沸点较低,所以Fe(CO)5是分子晶体;(3) ①(CN)2中存在碳碳键,结构式为![]() ,单键是σ键,三键中有1个 σ键和2个π键,所以分子中含有3个σ键,4个π键。②HCN分子的结构式是:H-C≡N,HCN分子中含有2个σ键和2个π键,C原子不含孤电子对,所以价层电子对数是2,中心原子C原子以sp杂化轨道成键;(4)①根据晶胞结构,B离子的坐标是(
,单键是σ键,三键中有1个 σ键和2个π键,所以分子中含有3个σ键,4个π键。②HCN分子的结构式是:H-C≡N,HCN分子中含有2个σ键和2个π键,C原子不含孤电子对,所以价层电子对数是2,中心原子C原子以sp杂化轨道成键;(4)①根据晶胞结构,B离子的坐标是(![]() );②根据均摊原则,晶胞中含I原子数1、含O原子数
);②根据均摊原则,晶胞中含I原子数1、含O原子数![]() 、含钾原子数
、含钾原子数![]() ,所以晶胞的摩尔质量是214g/mol,晶胞参数为a纳米,则晶胞体积是(a
,所以晶胞的摩尔质量是214g/mol,晶胞参数为a纳米,则晶胞体积是(a![]() 1.0×10-7)3cm3,所以密度是
1.0×10-7)3cm3,所以密度是![]() g·cm-3;③根据基本结构,若碘原子处在各顶点位置,则钾离子和氧原子在晶胞中的位置分别是体心、棱。
g·cm-3;③根据基本结构,若碘原子处在各顶点位置,则钾离子和氧原子在晶胞中的位置分别是体心、棱。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:

已知以下信息:
①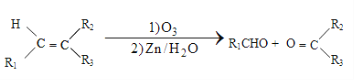
②1molB经上述反应可生成2molC,且C不能发生银镜反应。
③D属于单取代芳香烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的氢。
⑤
回答下列问题:
(1)由A生成B的化学方程式为______________,反应类型为________。
(2)D的化学名称是________,由D生成E的化学方程式为:_______________。
(3)G的结构简式为__________________。
(4)F的同分异构体中含有苯环的有多种(不考虑立体异构)。其中核磁共振氢谱中有4组峰,且面积比为6:2:2:1的是____________。(写出其中的一种的结构简式)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
![]()
反应条件1所选择的试剂为_______;反应条件2所选择的试剂为________;I的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
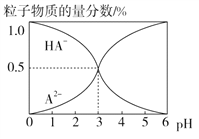
A. pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100
B. H2A的电离方程式:H2A![]() H++HA-
H++HA-
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-)
D. Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的说法,正确的是( )
A. 1 mol FeI2 与足量的氯气反应时转移的电子数为3 NA
B. 12 mol/L的浓硫酸50 ml 与足量的Cu加热反应,得到SO2为0.3 mol
C. 配制一定物质的量浓度溶液时,溶液的体积与容量瓶的量程一致
D. 1 mol NaHSO4固体中含离子总数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
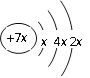 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为![]() 。下列比较中正确的是( )
。下列比较中正确的是( )
A. 原子半径:a>c>d>b B. 电负性a>b>d>c
C. 原子序数:d>a>c>b D. 最高价含氧酸的酸性c>d>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素代号 | A | B | D | E | X | Y | Z | W |
化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A. A的单质能将E单质从YE3的溶液中置换出来
B. A、Y、W的离子半径由大到小顺序是A>W>Y
C. X元素的单质不存在同素异形体
D. Z在DB2中燃烧生成两种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
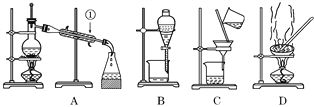
(1)从氯化钾溶液中得到氯化钾固体,选择装置______(填字母,下同);除去自来水中的可溶性物质,选择装置__________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________________________。
(3)装置A中①中水的进出方向是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离于方程式书写正确的是
A. 加热CuSO4溶液:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
B. 泡沫灭火器工作时的化学反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C. 以石墨为电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2+H2↑+OH-
Cl2+H2↑+OH-
D. 向NH4HCO3溶液中加入过量的NaOH(溶液)加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com