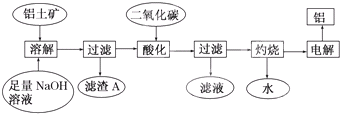
解:(1)分离不溶于水的固体和液体,可用过滤的方法,故答案为:过滤;
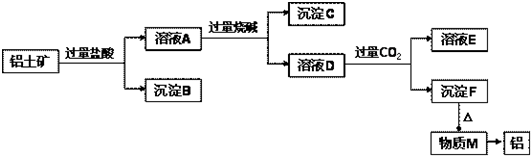
(2)铝土矿加过量盐酸溶解,MgO、Fe
2O
3、Al
2O
3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl
2+H
2O,Fe
2O
3+6HCl=2FeCl
3+3H
2O,Al
2O
3+6HCl=2AlCl
3+3H
2O.而SiO
2不与盐酸反应,所以沉淀B为不溶物SiO
2;
滤液A中含有的阳离子有Fe
3+、Al
3+、Mg
2+、H
+,加入过量烧碱,氢离子和氢氧化钠反应生成水,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,
所以沉淀C的成分是氢氧化镁、氢氧化铁;
氢氧化镁、氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以溶液D中大量存在的阴离子是AlO
2-、Cl
-、OH
-,
故答案为:SiO
2;Fe(OH)
3、Mg(OH)
2;AlO
2-、Cl
-、OH
-;
(3)根据流程图沉淀F为氢氧化铝,氢氧化铝受热分解生成氧化铝和水,反应为:2Al(OH)
3
Al
2O
3+3H
2O,
故答案为:2Al(OH)
3
Al
2O
3+3H
2O;
(4)溶液A中含有镁离子、铁离子和铝离子、氢离子,加入过量烧碱,氢离子和氢氧化钠反应生成水,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化镁、氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以溶液D中含偏铝酸根离子,通入过量CO
2,通入过量CO
2和二氧化碳反应生成氢氧化铝和碳酸氢根离子,离子方程式为:AlO
2-+CO
2+2H
2O=Al(OH)
3↓+HCO
3-,故答案为:AlO
2-+CO
2+2H
2O=Al(OH)
3↓+HCO
3-.
分析:(1)过滤是用来分离不溶性固体和液体混合物的方法;
(2)铝土矿可以看做MgO、Fe
2O
3、Al
2O
3、SiO
2组成,铝土矿加过量盐酸溶解后,MgO、Fe
2O
3、Al
2O
3和HCl反应溶解,而SiO
2和HCl不反应,不能溶解,不溶物为SiO
2;沉淀C为加入烧碱后的沉淀,所以沉淀为氢氧化物,Fe(OH)
3、Mg(OH)
2,溶液D中大量存在的阴离子是AlO
2-、Cl
-、OH
-;
(3)根据流程图沉淀F为氢氧化铝转化为物质M为氧化铝,据此书写方程式;
(4)溶液A中含有镁离子、铁离子和铝离子、氢离子,加入过量烧碱,氢离子和氢氧化钠反应生成水,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化镁、氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,溶液D中通入过量CO
2生成沉淀F,为偏铝酸根离子和二氧化碳能发生反应生成氢氧化铝沉淀.
点评:本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,题目难度不大.

 Al2O3+3H2O,
Al2O3+3H2O, Al2O3+3H2O;
Al2O3+3H2O;

 名校课堂系列答案
名校课堂系列答案
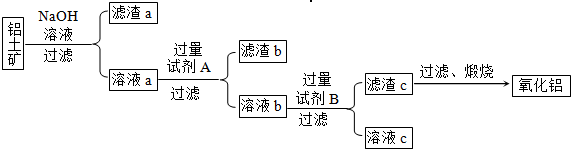
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程: