
【题目】碳族元素包括碳、硅、锗(Ge)、锡(Sn)、铅等,它们的单质及化合物广泛应用于我们生活的各个领域。锗和锡以前曾被用于半导体材料,铅被用来制造蓄电池。碳族元素在化合物中只有铅以低价形式存在时较稳定,其它元素在化合物中都是以高价形式存在比较稳定,回答下列问题:
I.(1)高岭土的成分中含Al2(Si2O5)(OH)4,请改写成氧化物的形式_________________.
(2)实验室用单质锡粉制取少量二氯化锡溶液,制取和保存的方法是(用文字叙述)_______________________________
(3)铅有多种氧化物,写出四氧化三铅与浓盐酸反应的离子方程式_____________________ .二氧化铅在空气中强热会得到一系列铅的其它氧化物。若把239g二氧化铅强热,当质量变为231g时,写出反应的化学方程式____________________________.
II.CH4–CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
CH4–CO2催化重整反应为:CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)= CH4 (g) ΔH=–75 kJ·mol1 ①
C(s)+O2(g)=CO2(g) ΔH=–394 kJ·mol1 ②
2C(s)+O2 (g)=2CO(g) ΔH=–222kJ·mol1 ③
(1)有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)若该反应在容积不变的绝热容器中进行,能够判断该反应已达到平衡的是____(填标号)。
A.c(CO2)/c(H2)不再发生变化
B.气体的密度不再发生变化
C.气体的平均摩尔质量不再发生变化
D.每有8molC-H键生成的同时有4molH-H键的断裂 E.容器的温度不再发生变化
(3)T℃时,在体积为10 L的容器中加入10 mol CH4、5 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,此温度下,该反应的化学平衡常数K=_______。
【答案】Al2O32SiO22H2O用过量的锡粉与盐酸反应,保存时过量的锡粉留在溶液中Pb3O4+8H++2Cl―=3Pb2++Cl2↑+4H2O4PbO2![]() 2Pb2O3+O2↑AACE1/3
2Pb2O3+O2↑AACE1/3
【解析】
I.(1)硅酸盐用氧化物表示:活泼金属氧化物在前,水在最后;根据原子守恒,高岭土的成分中含Al2(Si2O5)(OH)4,用氧化物的形式表示:Al2O32SiO22H2O;正确答案:Al2O32SiO22H2O。
(2)过量的锡粉与盐酸反应生成氯化锡和氢气;由于四氯化锡比较稳定,二氯化锡不稳定,所以为防止二氯化锡被氧化,保存二氯化锡溶液时要把过量的锡粉留在溶液中;正确答案:用过量的锡粉与盐酸反应,保存时过量的锡粉留在溶液中。
(3)四氧化三铅中含有+4价的铅,具有氧化性,四氧化三铅与浓盐酸反应生成氯化铅、氯气和水,离子方程式:Pb3O4+8H++2Cl―=3Pb2++Cl2↑+4H2O;二氧化铅的摩尔质量为239,所以若把239g二氧化铅(即为1mol)强热,当质量变为231g时,固体质量减小8g,反应应该是生成氧气,氧气的量为8/32=0.25mol,即1molPbO2加热反应,生成氧气0.25mol,若生成氧气1mol,消耗4 molPbO2,根据原子守恒可知该反应的化学方程式:4PbO2![]() 2Pb2O3+O2↑ ;正确答案:Pb3O4+8H++2Cl―=3Pb2++Cl2↑+4H2O ;4PbO2
2Pb2O3+O2↑ ;正确答案:Pb3O4+8H++2Cl―=3Pb2++Cl2↑+4H2O ;4PbO2![]() 2Pb2O3+O2↑ 。
2Pb2O3+O2↑ 。
II.(1)根据盖斯定律,重整反应为:③-①-②,所以ΔH=-222+394+75=247 kJ·mol1,所以该反应为吸热反应,提高甲烷的转化率的方法是高温低压,使平衡正向移动,A项正确;正确选项A。
(2)A. CO2为反应物,H2为生成物,当c(CO2)/c(H2)不再发生变化时,反应达到平衡状态,A正确;
B.反应前后气体的总质量不变,容器的体积不变,所以根据ρ=m/V可知,反应进行到任何时候,气体的密度都不再发生变化,不能判定反应是否达到平衡状态,B错误;
C.反应前后气体的总质量不变,反应后气体的总量增大,根据M=m/n可知,当气体的平均摩尔质量不再发生变化,反应达到平衡状态,C正确;
D.每有8molC-H键生成,属于v(逆),有4molH-H键的断裂,属于v(逆),速率同向,不能判定反应是否达到平衡状态,D错误;
E.若该反应在容积不变的绝热容器中进行,当容器的温度不再发生变化,各物质的浓度也不再发生变化,反应达到平衡状态,E正确;
正确选项ACE。
(3)已知c(CH4)= 10/10=1mol/L, c(CO2)=5/10=0.5 mol/L;根据以下步骤计算:
CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始浓度 1 0.5 0 0
变化浓度 0.25 0.5×50% 0.5 0.5
平衡浓度 0.75 0.25 0.5 0.5
此温度下,该反应的化学平衡常数K=c2(CO) c2(H2)/ c(CH4) c(CO2)=(0.52×0.52)/ (0.75×0.25)=1/3;正确答案:1/3。


科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A. 反应需在300 ℃进行可推测该反应是吸热反应
B. 使用催化剂可提高反应速率
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
实验 1 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液不显红色。 |
① 写出FeCl3溶液与KI溶液反应的离子方程式_______________________。
② 加入KSCN溶液的目的是_______________________________________。
③ 甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,改进实验方案,进行实验2。
实验2 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液显红色。 | |
ⅲ. 继续加入2 mL CCl4,充分振荡、静置。 | ⅲ. 液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是_________________________________________。
用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因________________。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I-![]() I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
① 为验证假设,乙同学设计并完成了实验3。
实验3 | 实验步骤 | 实验现象 |
ⅰ. 取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 | ⅰ. 液体分层,上层呈黄色,下层呈紫红色。 | |
ⅱ. 取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 | ⅱ. 液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是_________________________________。
② 甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-![]() I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中_________________。两支试管中的现象分别为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
4 | ⑧ | ⑨ | ⑩ |
(1)写出下列元素的元素符号:① _____ ②_____ ⑩_____
(2)在这些元素中,最活泼的金属元素是_____,最不活泼的元素是_____。
(3)这些元素的最高价氧化物对应水化物中,具有两性的是__________,它在水中的电离方程式为______________________________________________/span>
(4)将元素⑤、⑨和⑩的简单离子按半径由大到小排序____________________
(5)在③与④的单质中,化学性质较活泼的是____,写出一个可以验证该结论的化学事实______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于苯的硝化反应,下列说法不正确的是( )
A. 浓硫酸起了催化剂、吸水剂的作用
B. 加热50-60℃通常通过水浴来实现
C. 由于苯和硝酸都易挥发,所以通常需要加冷凝装置
D. 纯净得硝基苯为淡黄色比水重的液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度能使反应速率加快,下列叙述正确的是( )
A. 降低反应所需的活化能
B. 使反应体系的活化分子百分数增大
C. 体系中活化分子总数不变
D. 对于吸热反应、放热反应,反应速率同等程度加大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨—液氧燃料电池曾用于驱动潜艇,其示意图如图所示。
(1)该电池的总反应式为_____________,电极1发生的电极反应为__________;
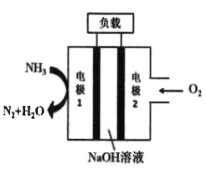
(2)下列说法正确的是______________;
A. 电极2是正极,发生还原反应
B. 电池工作时,Na+向电极1移动
C. 电流由电极2经外电路流向电极1
D. 该装置将化学能转化为电能再转化为机械能
(3)当电路中通过的电子数为0.4mol时,理论上需消耗标准状况下氧气的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的5种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;B元素原子结构示意图为![]() ;C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
;C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
(1)B位于第____________周期_____________族;
(2)E的离子结构示意图是_________________;DA中含有______________。(填化学键类型)
(3)用电子式表示BC2的形成过程________________________________________;(用具体元素表示)
(4)C、D、E三种元素简单离子的离子半径由大到小的顺序是______________________。(用具体离子符号表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com