
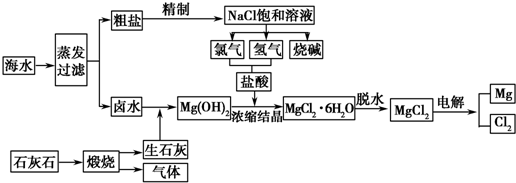
分析 (1)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
(2)直接加热MgCl2•3H2O晶体得不到无水MgCl2的原因是,加热生成的水中氯化镁水解生成氢氧化镁,得不到氯化镁,应在HCl气流中加热,抑制镁离子水解;
(3)根据能和金属镁发生反应的气体不能用来做冷却气体进行判断;
(4)①反应物是氯化钠溶液、氨气、二氧化碳,生成物中析出碳酸氢钠晶体;
②加热碳酸氢钠分解生成碳酸钠、二氧化碳和水;
(5)上述过程中电解饱和食盐水得到的氯气和氢气可以制备溶解氢氧化镁溶解所需要的盐酸,电解氯化镁生成的氯气循环使用,就地取材贝壳类煅烧得到生石灰,用来沉淀镁离子;
解答 解:(1)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:⑤加过量的BaCl2溶液,④加过量的Na2CO3溶液,②加过量的NaOH溶液,①过滤,③加适量的盐酸;或者,②加过量的NaOH溶液,⑤加过量的BaCl2溶液,④加过量的Na2CO3溶液,①过滤,③加适量的盐酸.
故答案为:④①③;
(2)直接加热MgCl2•3H2O晶体得不到无水MgCl2的原因是,加热生成的水中氯化镁水解生成氢氧化镁,得不到氯化镁,MgCl2•6H2O晶体在HCL气流中加热脱水,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2,6H2O受热产生的水汽,故能得到无水MgCl2;该气体的作用是抑制水解平衡MgCl2+H2O?Mg(OH)Cl+HCl正向进行;
故答案为:HCl;抑制水解平衡MgCl2+H2O?Mg(OH)Cl+HCl正向进行;
(3)能和金属镁发生反应的气体:氮气、氧气、二氧化碳,所以可以用氢气做镁蒸气的冷却剂,故答案为:A;
(4)①反应物是氯化钠溶液、氨气、二氧化碳,生成物中析出碳酸氢钠晶体,然后根据质量守恒定律写出化学反应式配平即可.
故答案为:NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl;
②加热碳酸氢钠晶体可制得纯碱,可知反应物是碳酸氢钠,反应条件是加热,生成物中有纯碱,然后根据质量守恒定律写出化学反应式.
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(5)上述过程中电解饱和食盐水得到的氯气和氢气可以制备溶解氢氧化镁溶解所需要的盐酸,生产过程中的部分产物可作为制备另一种产品的原料,电解氯化镁生成的氯气循环使用,整个过程体现了原料的综合利用,就地取材贝壳类煅烧得到生石灰,用来沉淀镁离子,体现了就地取材、降低成本的设计思想,故ABC正确,
故答案为:ABC.
点评 本题主要考查了海水制金属镁的过程以及原理、粗盐提纯方法,掌握实验的原理和操作方法结合流程图信息是解答本题的关键,题目难度中等.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| A | Cl2 | SO2 | Ba(NO3)2 |
| B | HCl | CO2 | 石灰水 |
| C | NH3 | SO2 | Ba(OH)2 |
| D | NO2 | SO2 | BaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 每个去甲肾上腺素分子中含有 3 个酚羟基 | |
| B. | 去甲肾上腺素分子难溶于水 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com