
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
分析 ①Al2O3和氢氧化钠反应生成NaAlO2和水,偏铝酸钠溶液中通入二氧化碳生成Al(OH)3和碳酸钠;
②S在氧气中燃烧生成二氧化硫;
③饱和NaCl溶液中通入氨气再通入二氧化碳生成NaHCO3,碳酸氢钠受热分解产生Na2CO3;
④Fe2O盐酸反应生成FeCl3和水,氯化铁溶液加热蒸发生成氢氧化铁.
解答 解:①Al2O3和氢氧化钠反应生成NaAlO2和水,偏铝酸钠溶液中通入二氧化碳生成Al(OH)3和碳酸钠,可以实现各步转化,故正确;
②S在氧气中燃烧生成二氧化硫,不能一步转化,故错误;
③饱和NaCl溶液中通入氨气再通入二氧化碳生成溶解度极小的NaHCO3,碳酸氢钠受热分解产生Na2CO3,可以实现各步转化,故正确;
④Fe2O盐酸反应生成FeCl3和水,氯化铁溶液加热蒸发生成氢氧化铁,因氯化铁水解,所以不能得到无水氯化铁,故错误;
故选A.
点评 本题考查化合物的性质,题目难度不大,熟练掌握物质的性质是解决此类问题的关键,正确运用物质分类及反应规律则是解决此类问题的有效方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
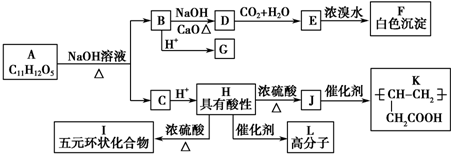
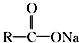 +NaOH$→_{△}^{CaO}$R═H+Na2CO3
+NaOH$→_{△}^{CaO}$R═H+Na2CO3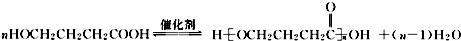 .
. .
.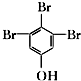 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
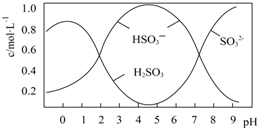 葡萄酒常用Na2S2O5做抗氧化剂.
葡萄酒常用Na2S2O5做抗氧化剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
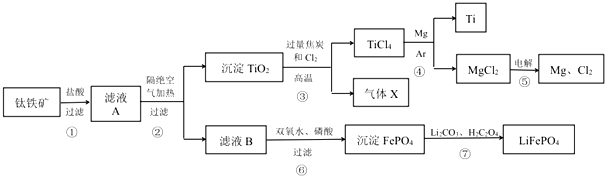
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
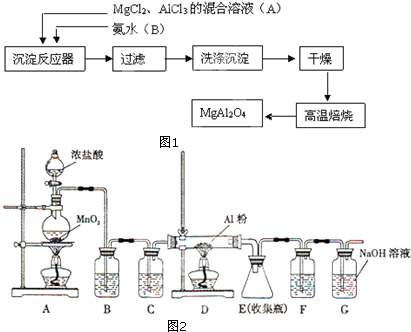
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 5 | 15 | 25 | 35 |
| N(M)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 35s时,N的浓度为0.80mol•L-1 | |
| B. | 达到平衡时,M的转化率为80% | |
| C. | 相同温度下若起始时向容器中充入1.0molP,则达到平衡时P的浓度为0.1mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20molM、0.20molN和1.0molP,反应达到平衡前v(逆)<v(正) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
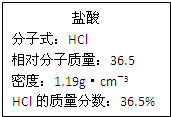 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com