
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体| 组别 | c(HCl)/(mol•L-1) | 温度/(℃) | 状态 |
| 1 | 2.0 | 30 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.0 | 20 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4、3、2、1 | B. | 4、2、1、3 | C. | 3、4、2、1 | D. | 4、1、2、3 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X、W分别与钠形成的化合物摩尔质量相同,且每种化合物中阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为离子化合物 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂 | |
| B. | 丙三醇的沸点比乙二醇的沸点高,可用于配制化妆品 | |
| C. | 这两种多元醇都易溶于水,但难溶于有机溶剂 | |
| D. | 丙三醇可以制造炸药,乙二醇是制涤纶的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
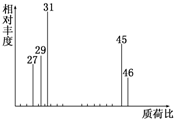 为了测定某有机物A的结构,做如下实验:
为了测定某有机物A的结构,做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
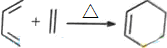 .根据下列转化流程,回答问题:
.根据下列转化流程,回答问题: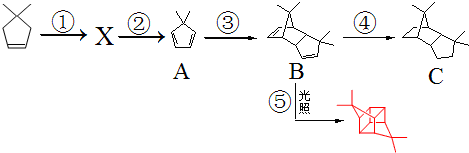
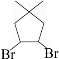 .
.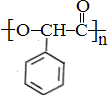 的合成路线:
的合成路线: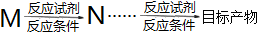 )
)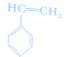 $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$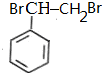 $→_{△}^{NaOH溶液}$
$→_{△}^{NaOH溶液}$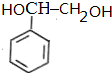 $\stackrel{[O]}{→}$
$\stackrel{[O]}{→}$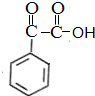 $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$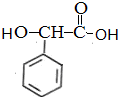 $\stackrel{浓H_{2}SO_{4}△}{→}$
$\stackrel{浓H_{2}SO_{4}△}{→}$ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com