
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol Cl2与过量的镁铁反应,转移2nA个电子
B.常温下,16g CH4含有8nA个电子
C.1L 0.5 mol·L-1Na2SO4溶液中含有nA个SO42-
D.常温常压下,22.4LCO2含有nA个CO2分子
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:选择题
在溶液中加入足量Na2O2后仍能大量共存的离子组是
A.K+、AlO2-、Cl-、SO42– B.NH4+、Ba2+、Cl-、NO3-
C.Ca2+、Fe2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32–
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:填空题
中学化学常见有机物A(C6H6O)能合成紫外线吸收剂BAD和某药物中间体F,合成路线为:

已知:BAD的结构简式为:
F的结构简式为:
C中含氧官能团的名称 ,W的结构简式 。
(2)反应类型 A→B 。
(3)1mol C充分反应可以消耗 mol Br2 ;C和过量 NaOH溶液反应的化学方程式 。
(4)C→D的过程中可能有另一种产物D1,D1的结构简式 。
(5)E的结构简式为 。反应类型 E→F 。
(6)W的同分异构体有多种,写出一种符合以下要求的W的同分异构体的结构简式:
① 遇FeCl3溶液呈紫色; ② 能发生银镜反应;③ 苯环上的一氯代物只有两种。 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市番禺区高考统考(一)理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )

A.Y的最高化合价为+6
B.离子半径:W>Q>Y>X
C.氢化物的沸点:Y>Q
D.最高价氧化物的水化物的酸性:W>Q
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:选择题
已知反应①:

化合物Ⅱ可由化合物Ⅲ合成:

(1)化合物Ⅰ的分子式为 。反应①的反应类型为 。
(2)过量的化合物Ⅰ与HOOCCH2CH2COOH发生酯化反应,反应的化学方程式为 (注明条件)。
(3)化合物Ⅲ的结构简式为 。化合物Ⅲ可与NaOH乙醇溶液共热,反应的化学方程式 。
(4)化合物Ⅰ在一定条件下氧化生成化合物Ⅳ(分子式为C9H10O),化合物Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ的核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为2:2:1,Ⅴ的结构简式为 。
(5)一定条件下,1分子 与1分子
与1分子 也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:填空题
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
(1)写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)对反应Ⅰ,在一定温度下反应达到平衡的标志是 (选填编号)
a.反应物不再转化为生成物 b.平衡常数K不再增大
c.CO2的转化率不再增大 d.混合气体的平均相对分子质量不再改变
(3)在密闭容器中,反应Ⅰ在一定条件达到平衡后,其它条件恒定,能提高CO2转化率的措施是 (选填编号)
A、降低温度 B、补充CO2 C、加入催化剂 D、移去甲醇
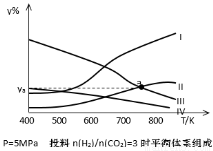
(4)研究员以生产乙醇为研究对象,在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。表示CH3CH2OH组分的曲线是 ;图中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya= %(计算结果保留三位有效数字)
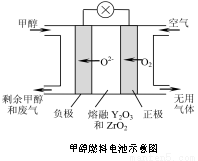
(5)一种以甲醇作燃料的电池示意图如图。写出该电池放电时负极的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:选择题
下列措施不合理的是
A.用饱和Na2CO3溶液除去乙酸乙酯中的乙酸
B.用酸性高锰酸钾溶液鉴别苯和甲苯
C.实验室用稀盐酸与MnO2混合加热制备Cl2
D.用CCl4萃取碘水中的碘
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:填空题
平衡是化学反应原理中的重要内容。按要求回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1
2NO(g)+O2(g) 2NO2(g) ΔH2 平衡常数为K2
2NO2(g) ΔH2 平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=______ (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH=______ (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
(2)已知A(g)+B(g)  C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
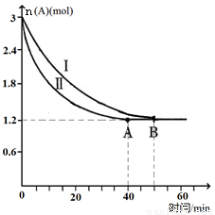
①实验Ⅱ可能改变的条件是_______________。
②T1℃时该反应的平衡常数为_____(用分数表 示),达到平衡时,A的反应速率为____。
(3)已知HCN溶液的电离平衡常数Ka=10-5 mol?L-1,c平衡(HCN)≈c起始(HCN),水的电离可不计,则此温度下0.1 mol?L-1的HCN溶液的pH=_________。
(4)对于0.1mol?L-1 Na2CO3溶液,该溶液中离子浓度由大到小的顺序是______,向该溶液中加水稀释的过程中,c(H2CO3)逐渐____(填“增大”“不变”或“减小”, 下同) ,c(H2CO3)/ c(CO32-)逐渐______。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:填空题
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
开始沉淀时 | 1.5 | 3.4 | 6.3 |
完全沉淀时 | 2.8 | 4.7 | 8.3 |
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是 。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是 。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是 。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是 。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com